题目内容
氨气与氧化铜反应的化学方程式为:3CuO+2NH3
3Cu+N2+3H2O,完成下列填空:
(1)该反应的还原剂是 ,发生还原反应的物质是 .
(2)在方程式上标出电子转移的方向和数目.
(3)若反应中转移0.90mol电子,则生成铜的质量为 g.
| 催化剂 |
| 加热 |
(1)该反应的还原剂是
(2)在方程式上标出电子转移的方向和数目.
(3)若反应中转移0.90mol电子,则生成铜的质量为
考点:氧化还原反应
专题:氧化还原反应专题
分析:反应3CuO+2NH3
3Cu+N2+3H2O中,Cu元素化合价由+2价降低到0价,被还原,N元素化合价由-3价升高到0价,被氧化,结合化合价的变化判断电子的转移以及方程式的计算.
| 催化剂 |
| 加热 |
解答:
解:(1)Cu元素化合价由+2价降低到0价,被还原,CuO为氧化剂,N元素化合价由-3价升高到0价,被氧化,NH3为还原剂,故答案为:NH3;CuO;
(2)反应中Cu元素得电子,化合价降低,N元素失电子,化合价升高,转移电子数目为6,电子转移的方向和数目可表示为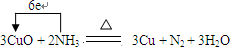 ,故答案为:
,故答案为: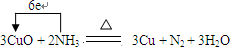 ;
;
(3)由方程式可知,转移2mol电子,则生成1molCu,则转移0.90mol电子,应生成0.45molCu,m(Cu)=0.45mol×64g/mol=28.8g,
故答案为:28.8.
(2)反应中Cu元素得电子,化合价降低,N元素失电子,化合价升高,转移电子数目为6,电子转移的方向和数目可表示为
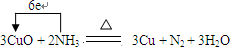 ,故答案为:
,故答案为: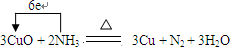 ;
;(3)由方程式可知,转移2mol电子,则生成1molCu,则转移0.90mol电子,应生成0.45molCu,m(Cu)=0.45mol×64g/mol=28.8g,
故答案为:28.8.
点评:本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高频考点,注意从元素化合价的角度解答该题,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
下列各装置中,不能构成原电池的是( )
A、 盐酸 |
B、 硫酸铜溶液 |
C、 稀硫酸 |
D、 稀硫酸 |
下列反应的离子方程式书写正确的是( )
| A、氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu |
| B、稀硫酸与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| C、碳酸钙与盐酸反应:2H++CO32-=H2O+CO2↑ |
| D、氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
我国赢得2008年第29届夏季奥运会的举办权.为向世界展现一个新的形象,某校同学提出下列建议:①开发新能源,减少化石燃料的燃烧;②开发生产无汞电池;③分类回收垃圾;④提倡使用一次性发泡塑料餐具和塑料袋;⑤提倡使用手帕,减少餐巾纸的使用;⑥提倡不使用含磷洗衣粉.你认为可以采纳的是( )
| A、①②③④⑥ | B、②③④⑤⑥ |
| C、①②③⑤⑥ | D、全部 |
关于化学反应速率、化学平衡的说法中错误的是( )
| A、其它条件不变时,升高温度化学反应速率加快 |
| B、其它条件不变时,增大浓度化学反应速率加快 |
| C、当反应物的浓度与生成物的浓度相等时,化学反应达到化学平衡 |
| D、当正反应的速率与逆反应的速率相等时,化学反应达到化学平衡 |

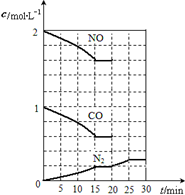 在铂-铑“三效”催化剂作用下,以下反应可以将汽车尾气中2种有
在铂-铑“三效”催化剂作用下,以下反应可以将汽车尾气中2种有