题目内容
下列各组分子中,都属于含极性键的非极性分子的是( )
| A、CO2 H2S |
| B、C60 C2H4 |
| C、C2H4 CH4 |
| D、NH3 HCl |
考点:极性键和非极性键,极性分子和非极性分子
专题:化学键与晶体结构
分析:同种元素的原子间形成的共价键属于非极性键;不同元素的原子间形成的共价键属于极性键;
正电荷中心和负电荷中心不相重合的分子为极性分子;正电荷中心和负电荷中心相重合的分子属于非极性分子;
分子极性的判断方法为:分子的极性由共价键的极性及分子的空间构型两个方面共同决定.
正电荷中心和负电荷中心不相重合的分子为极性分子;正电荷中心和负电荷中心相重合的分子属于非极性分子;
分子极性的判断方法为:分子的极性由共价键的极性及分子的空间构型两个方面共同决定.
解答:
解:A、二氧化碳为极性键形成的非极性分子,氯化氢为极性键形成的极性分子,故A错误;
B、乙烯为极性键形成的非极性分子,而 C60为同种元素构成的化学键属于非极性键,故B错误;
C、乙烯和甲烷中化学键都是不同元素构成的,属于极性键;二者分子中正电荷中心和负电荷中心相重合,属于非极性分子,故C正确;
D、氨气和氯化氢都是由极性键形成的分子,二者正电荷中心和负电荷中心不相重合,属于极性分子,故D错误;
故选C.
B、乙烯为极性键形成的非极性分子,而 C60为同种元素构成的化学键属于非极性键,故B错误;
C、乙烯和甲烷中化学键都是不同元素构成的,属于极性键;二者分子中正电荷中心和负电荷中心相重合,属于非极性分子,故C正确;
D、氨气和氯化氢都是由极性键形成的分子,二者正电荷中心和负电荷中心不相重合,属于极性分子,故D错误;
故选C.
点评:本题考查了键的极性和分子的极性判断,题目难度不大,本题侧重了对学生灵活运用基础知识解决实际问题的能力的培养.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
能正确表示下列反应的离子方程式是( )
| A、明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
| B、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| C、钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ |
| D、硫酸铜溶液中加入过量氨水:Cu2++2OH-═Cu(OH)2↓ |
某单质能与足量浓HNO3反应放出NO2气体,若参加反应的单质和硝酸的物质的量之比为1:a,则该元素在反应中所显示的化合价是 ( )
| A、+2a | ||
| B、+a | ||
C、+
| ||
D、+
|
某溶液中大量存在五种离子:NO3-、SO42-、Fe3+、H+、X,其物质的量之比为:n(NO3-):n(SO42-):n(Fe3+):n(H+):n(X)=2:3:1:3:1,则X可能为( )
| A、Fe2+ |
| B、Mg2+ |
| C、Cl- |
| D、Ba2+ |
某溶液中加入铝粉,有H2放出,在该溶液中一定能大量共存的离子组是( )
| A、K+、Na+、Cl-、SO42- |
| B、Na+、NH4+、SO42-、HCO3- |
| C、Na+、Ba2+、NO3-、Cl- |
| D、K+、Na+、NO3-、AlO2- |
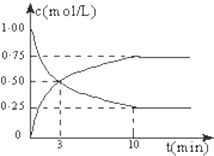 在体积恒定的密闭容器中,充入2mol CO2和5mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示:
在体积恒定的密闭容器中,充入2mol CO2和5mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示:
 熔融碳酸盐燃料电池(MCFS),发明于1889年.现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示.请回答下列问题:
熔融碳酸盐燃料电池(MCFS),发明于1889年.现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示.请回答下列问题: