题目内容
4.短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )| A. | 元素X 的简单气态氢化物的热稳定性比W 的强 | |
| B. | 元素W 的最高价氧化物对应水化物的酸性比Z 的弱 | |
| C. | 化合物YX、ZX2、WX3 中化学键的类型相同 | |
| D. | 元素X 的简单气态氢化物的沸点比W的低 |
分析 短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,则Y为Mg元素,Z单质可制成半导体材料,Z为Si元素.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,则Y为Mg元素,Z单质可制成半导体材料,Z为Si元素.
A.非金属性O>S,故元素O的简单气态氢化物稳定性比硫的强,故A正确;
B.非金属Z(Si)<W(S),故元素S的最高价氧化物对应水化物的酸性比Si的强,故B错误;
C.化合物MgO为离子化合物,含有离子键,SiO2、SO3属于共价化合物,含有共价键,故C错误;
D.水分子之间形成氢键,而硫化氢分子之间不能,故水的沸点高于硫化氢的,故D错误.
故选:A.
点评 本题考查结构性质与位置关系、元素周期律等,难度不大,推断元素是解题的关键,注意对基础知识的全面掌握.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
19.下列各对物质中互为同系物的是( )
| A. | CH3-CH=CH2和CH3-CH2-CH=CH2 | B. | CH3-CH3和CH3-CH=CH2 | ||
| C. | CH3-CH2-CH3和CH3-CH=CH2 | D. | CH3-CH2-CH2-CH3和CH3-CH2-CHCl2 |
9.aLCO2气体通过足量Na2O2后所得气体再与bLNO混合时,可得到c L气体(气体体积均在相同状况下测定).下列表达式错误的是( )
| A. | 若a<b,则c<$\frac{1}{2}$(a+b) | B. | 若a<b,则c>$\frac{1}{2}$(a+b) | C. | 若a>b,则c=$\frac{1}{2}$(a+b) | D. | 若a=b,则c=$\frac{1}{2}$(a+b) |
13.下表为部分短周期元素化合价及其相应原子半径的数据.请回答下列问题:
(1)元素G在周期中的位置是第二周期ⅣA族;元素F所形成的常见单质的电子式为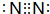 .
.
(2)A、C、E的氢化物稳定性顺序由大到小是HF>H2O>H2S.(用化学式回答)
(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是SOCl2+H2O=SO2↑+2HCl.
(4)请写出B的单质的一种重要用途用作半导体材料、制造合金、光电池、计算机芯片等.
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.117 | 0.074 | 0.110 | 0.071 | 0.075 | 0.077 | 0.099 |
| 最高化合价 | +6 | +4 | +5 | +5 | +4 | +7 | ||
| 最低化合价 | -2 | -4 | -2 | -3 | -1 | -3 | -4 | -1 |
 .
.(2)A、C、E的氢化物稳定性顺序由大到小是HF>H2O>H2S.(用化学式回答)
(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是SOCl2+H2O=SO2↑+2HCl.
(4)请写出B的单质的一种重要用途用作半导体材料、制造合金、光电池、计算机芯片等.
14. A、B、D、E、F是原子序数依次增大的五种前四周期元素,相关信息如下:
A、B、D、E、F是原子序数依次增大的五种前四周期元素,相关信息如下:
(1)D元素是氮(填元素名称);D、E两元素第一电离能较大的是N(填元素符号);原因是氮元素原子2p轨道为半满稳定状态,能量较低,第一电离能大于元素的.
(2)B、D元素分别与A元素形成的最简单分子的VSERP模型分别为四面体形、四面体形(用文字描述),两者沸点较高的是NH3(填化学式),原因是氨气分子之间形成氢键,而甲烷分子之间不能形成氢键.
(3)F元素基态原子价电子排布图为 ,能量最高的电子占据的能级符号为3d,该能级所在能层具有的原子轨道数为9.
,能量最高的电子占据的能级符号为3d,该能级所在能层具有的原子轨道数为9.
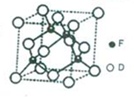
(4)D、F形成的一种晶体,晶胞如图所示,该晶体化学式为TiN.已知晶体的密度为ρ g•cm-3,阿伏伽德罗常数为NA,则晶胞边长为$\root{3}{\frac{248}{ρ{N}_{A}}}$×1010pm.
 A、B、D、E、F是原子序数依次增大的五种前四周期元素,相关信息如下:
A、B、D、E、F是原子序数依次增大的五种前四周期元素,相关信息如下:| A | 原子半径最小的元素 |
| B | 原子核外电子有6种不同的运动状态 |
| E | 原子L电子层上有两个未成对电子 |
| F | 原子最外层有2个电子,次外层电子数为D原子最外层电子数的2倍 |
(2)B、D元素分别与A元素形成的最简单分子的VSERP模型分别为四面体形、四面体形(用文字描述),两者沸点较高的是NH3(填化学式),原因是氨气分子之间形成氢键,而甲烷分子之间不能形成氢键.
(3)F元素基态原子价电子排布图为
 ,能量最高的电子占据的能级符号为3d,该能级所在能层具有的原子轨道数为9.
,能量最高的电子占据的能级符号为3d,该能级所在能层具有的原子轨道数为9.(4)D、F形成的一种晶体,晶胞如图所示,该晶体化学式为TiN.已知晶体的密度为ρ g•cm-3,阿伏伽德罗常数为NA,则晶胞边长为$\root{3}{\frac{248}{ρ{N}_{A}}}$×1010pm.
 系统命名:3,3-二甲基-1-丁炔.
系统命名:3,3-二甲基-1-丁炔.
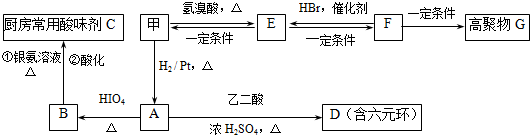
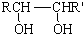 $→_{△}^{HIO_{4}}$ RCHO+R′CHO
$→_{△}^{HIO_{4}}$ RCHO+R′CHO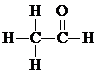 .
.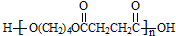 .
.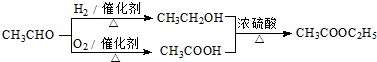
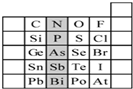 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.请用元素符号或化学式填空:
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.请用元素符号或化学式填空: