题目内容
13.原电池是能把化学能转变成电能的装置,下列关于Zn-Cu(H2SO4)原电池的说法中错误的是( )| A. | 负极:Zn-2e-═Zn2+(氧化反应) | B. | 正极:O2+2H2O+4e-═4OH-(还原反应) | ||
| C. | 电流流向:Cu→Zn | D. | 正极:2H++2e-═H2↑(还原反应) |
分析 锌比铜活泼,锌为负极,铜为正极,负极反应为Zn-2e-=Zn2+,正极反应为2H++2e-=H2↑,以此解答该题.
解答 解:A.锌为负极,被氧化,发生氧化反应,电极方程式为Zn-2e-═Zn2+,故A正确;
B.铜为正极,正极反应为2H++2e-=H2↑,故B错误;
C.锌为负极,铜为正极,电流从正极流向负极,即Cu→Zn,故C正确;
D.铜为正极,发生还原反应,正极反应为2H++2e-=H2↑,故D正确;
故选B.
点评 本题考查原电池知识,侧重于学生的分析能力的考查,为高考高频考点,注意把握原电池的原理和电极反应,注重相关基础知识的积累,难度不大.

练习册系列答案
相关题目
4.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 长期大量使用(NH4)2SO4化肥会使土壤酸化,而使用尿素[CO(NH2)2]则不会改变土壤酸碱性 | |
| B. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| C. | 普通玻璃属于无机非金属材料,有机玻璃属于新型无机非金属材料 | |
| D. | 氟氯烃是安全、环保的制冷剂 |
1.无水硫酸亚铁是白色粉末,溶于水,水溶液为浅绿色,常见其七水合物(绿矾FeSO4•7H2O ),在潮湿空气中易氧化成难溶于水的棕黄色碱式硫酸铁Fe(OH)SO4.主要用于净水、照相制版及治疗缺铁性贫血等.
某化学兴趣小组欲确定某FeSO4•7H2O样品加热后的产物,实验步骤如下:
①检查装置的气密性;②称取2.78g样品,置于B试管中;③打开活塞K,从C处通入某种气体;④关闭K,对试管B充分加热;⑤打开活塞K,从C处再通入该气体.
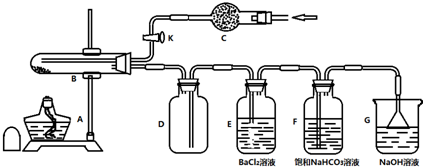
(1)E中产生白色沉淀,说明FeSO4•7H2O分解有SO3生成.
(2)步骤③中从C处通入的气体作用为将装置中的空气全部赶出,并将FeSO4•7H2O的分解产物全部排出,该气体可以为C.
A.SO2 B.Cl2 C.N2 D.NH3
若不通入气体,则E中发生的副反应为2SO2+O2+2BaCl2+2H2O=2BaSO4↓+4HCl.
(3)甲同学将F中反应后溶液共100mL取出,用0.020mol•L-1的酸性KMnO4溶液进行滴定,KMnO4溶液应盛装在酸式滴定管中.滴定过程中反应的离子方程式为:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O;滴定完毕,三次实验记录KMnO4标准溶液的读数如下:
通过计算,甲同学认为B中的固体产物化学式为Fe2O3.
(4)设计实验证明FeSO4•7H2O水溶液呈酸性的原因是Fe2+的水解:取少量FeSO4•7H2O水溶液于试管中,先加Fe粉,再滴入几滴石蕊试液,试管中溶液微红,然后加热试管中的溶液,若溶液红色加深,则说明FeSO4•7H2O水溶液呈酸性的原因是Fe2+的水解.
某化学兴趣小组欲确定某FeSO4•7H2O样品加热后的产物,实验步骤如下:
①检查装置的气密性;②称取2.78g样品,置于B试管中;③打开活塞K,从C处通入某种气体;④关闭K,对试管B充分加热;⑤打开活塞K,从C处再通入该气体.

(1)E中产生白色沉淀,说明FeSO4•7H2O分解有SO3生成.
(2)步骤③中从C处通入的气体作用为将装置中的空气全部赶出,并将FeSO4•7H2O的分解产物全部排出,该气体可以为C.
A.SO2 B.Cl2 C.N2 D.NH3
若不通入气体,则E中发生的副反应为2SO2+O2+2BaCl2+2H2O=2BaSO4↓+4HCl.
(3)甲同学将F中反应后溶液共100mL取出,用0.020mol•L-1的酸性KMnO4溶液进行滴定,KMnO4溶液应盛装在酸式滴定管中.滴定过程中反应的离子方程式为:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O;滴定完毕,三次实验记录KMnO4标准溶液的读数如下:
| 滴定次数实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 1.50 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 19.85 | 20.22 | 19.98 |
(4)设计实验证明FeSO4•7H2O水溶液呈酸性的原因是Fe2+的水解:取少量FeSO4•7H2O水溶液于试管中,先加Fe粉,再滴入几滴石蕊试液,试管中溶液微红,然后加热试管中的溶液,若溶液红色加深,则说明FeSO4•7H2O水溶液呈酸性的原因是Fe2+的水解.
18.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 乙醇溶液 | B. | 氯化钠溶液 | C. | 氢氧化钠溶液 | D. | 氢氧化铁胶体 |
20.欲使Ag2CO3(Ksp=8.3×10-12)转化为Ag2C2O4(Ksp=5.3×10-12),必须使( )
| A. | c(C2O42-)<0.64c(CO32-) | B. | c(CO32-)>1.56c(C2O42-) | ||
| C. | c(C2O42-)<1.56c(CO32-) | D. | c(C2O42-)>0.64c(CO32-) |
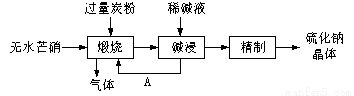

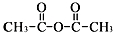
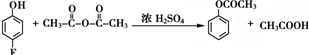 .
.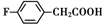 、
、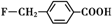
 和乙酸酐为原料制备
和乙酸酐为原料制备 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3COOH$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOCH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3COOH$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOCH}$CH3COOCH2CH3.