题目内容
9.短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )| A. | B与A只能组成BA3化合物 | |
| B. | C、D、E形成的化合物与稀硫酸可能发生氧化还原反应 | |
| C. | A、B、C形成的化合物一定不能发生水解 | |
| D. | E的氧化物一定有强的氧化性 |
分析 短周期中的A、B、C、D、E五种元素,原子序数依次增大,C2-与D+的核外电子数相等,结合所带电荷可知,C为O元素、D为Na;A和D,A为非金属元素,则A为H元素;C和E分别同主族,E为S元素;A与B的原子序数之和等于C的原子序数,则B的原子序数=8-1=7,故B为N元素,据此解答.
解答 解:短周期中的A、B、C、D、E五种元素,原子序数依次增大,C2-与D+的核外电子数相等,结合所带电荷可知,C为O元素、D为Na;A和D,A为非金属元素,则A为H元素;C和E分别同主族,E为S元素;A与B的原子序数之和等于C的原子序数,则B的原子序数=8-1=7,故B为N元素,
A.N与H元素可以形成NH3、N2H4等,故A错误;
B.O、Na、S形成的化合物Na2S2O3,可与稀硫酸发生氧化还原反应,故B正确;
C.H、N、O形成的化合物NH4NO3能发生水解反应,故C错误;
D.E的氧化物是二氧化硫和三氧化硫,其中二氧化硫是强还原性弱氧化性,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,推断元素是解题的关键,C2-与D+的核外电子数相等是推断突破口,B选项为易错点,难度中等.

练习册系列答案
相关题目
4.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 长期大量使用(NH4)2SO4化肥会使土壤酸化,而使用尿素[CO(NH2)2]则不会改变土壤酸碱性 | |
| B. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| C. | 普通玻璃属于无机非金属材料,有机玻璃属于新型无机非金属材料 | |
| D. | 氟氯烃是安全、环保的制冷剂 |
14.铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.实验室现有下列试剂:0.01mol/L 酸性KMnO4溶液、0.1mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水.请你协助他们探究所得溶液和气体的成分.
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有SO2、H2中的一种或两种.
【实验探究】
【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:不正确,若溶液中含有Fe3+,则无法检验溶液中是否含有Fe2+.
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有SO2、H2中的一种或两种.
【实验探究】
| 实验操作 | 预期现象 | 结论 | |
| 验证猜想Ⅰ | 步骤①:取少量0.01mol/L酸性KMnO4溶液,滴入所得溶液 | 溶液紫红色褪去 | 含有Fe2+(或溶液紫红色不褪去,不含Fe2+) |
| 步骤②:另取少量所得溶液,滴加KI-淀粉溶液 | 含有Fe3+ | ||
| 验证猜想Ⅱ | 将所得气体通入如图装置: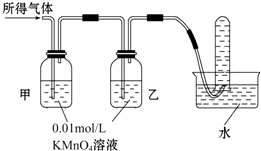 | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体 | 含有两种气体 |
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:不正确,若溶液中含有Fe3+,则无法检验溶液中是否含有Fe2+.
1.无水硫酸亚铁是白色粉末,溶于水,水溶液为浅绿色,常见其七水合物(绿矾FeSO4•7H2O ),在潮湿空气中易氧化成难溶于水的棕黄色碱式硫酸铁Fe(OH)SO4.主要用于净水、照相制版及治疗缺铁性贫血等.
某化学兴趣小组欲确定某FeSO4•7H2O样品加热后的产物,实验步骤如下:
①检查装置的气密性;②称取2.78g样品,置于B试管中;③打开活塞K,从C处通入某种气体;④关闭K,对试管B充分加热;⑤打开活塞K,从C处再通入该气体.
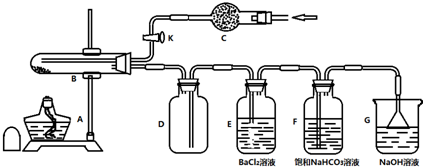
(1)E中产生白色沉淀,说明FeSO4•7H2O分解有SO3生成.
(2)步骤③中从C处通入的气体作用为将装置中的空气全部赶出,并将FeSO4•7H2O的分解产物全部排出,该气体可以为C.
A.SO2 B.Cl2 C.N2 D.NH3
若不通入气体,则E中发生的副反应为2SO2+O2+2BaCl2+2H2O=2BaSO4↓+4HCl.
(3)甲同学将F中反应后溶液共100mL取出,用0.020mol•L-1的酸性KMnO4溶液进行滴定,KMnO4溶液应盛装在酸式滴定管中.滴定过程中反应的离子方程式为:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O;滴定完毕,三次实验记录KMnO4标准溶液的读数如下:
通过计算,甲同学认为B中的固体产物化学式为Fe2O3.
(4)设计实验证明FeSO4•7H2O水溶液呈酸性的原因是Fe2+的水解:取少量FeSO4•7H2O水溶液于试管中,先加Fe粉,再滴入几滴石蕊试液,试管中溶液微红,然后加热试管中的溶液,若溶液红色加深,则说明FeSO4•7H2O水溶液呈酸性的原因是Fe2+的水解.
某化学兴趣小组欲确定某FeSO4•7H2O样品加热后的产物,实验步骤如下:
①检查装置的气密性;②称取2.78g样品,置于B试管中;③打开活塞K,从C处通入某种气体;④关闭K,对试管B充分加热;⑤打开活塞K,从C处再通入该气体.

(1)E中产生白色沉淀,说明FeSO4•7H2O分解有SO3生成.
(2)步骤③中从C处通入的气体作用为将装置中的空气全部赶出,并将FeSO4•7H2O的分解产物全部排出,该气体可以为C.
A.SO2 B.Cl2 C.N2 D.NH3
若不通入气体,则E中发生的副反应为2SO2+O2+2BaCl2+2H2O=2BaSO4↓+4HCl.
(3)甲同学将F中反应后溶液共100mL取出,用0.020mol•L-1的酸性KMnO4溶液进行滴定,KMnO4溶液应盛装在酸式滴定管中.滴定过程中反应的离子方程式为:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O;滴定完毕,三次实验记录KMnO4标准溶液的读数如下:
| 滴定次数实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 1.50 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 19.85 | 20.22 | 19.98 |
(4)设计实验证明FeSO4•7H2O水溶液呈酸性的原因是Fe2+的水解:取少量FeSO4•7H2O水溶液于试管中,先加Fe粉,再滴入几滴石蕊试液,试管中溶液微红,然后加热试管中的溶液,若溶液红色加深,则说明FeSO4•7H2O水溶液呈酸性的原因是Fe2+的水解.
18.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 乙醇溶液 | B. | 氯化钠溶液 | C. | 氢氧化钠溶液 | D. | 氢氧化铁胶体 |

 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.