题目内容
3.新制氯水中含有Cl2、H2O、HClO、H+、Cl-等粒子,根据下列性质选择恰当的粒子进行填空.(1)使新制氯水呈现浅黄绿色的物质是Cl2;
(2)能起杀菌消毒作用,光照易分解的弱酸是HClO;
(3)能与硝酸银溶液作用生成白色沉淀的离子是Cl-.
(4)取少量新制氯水于试管中,加入FeCl2溶液,发现很快变黄,起作用的成分是Cl2,说明氯气具有强氧化性.有关反应的离子方程式为2Fe2++Cl2=2Cl-+2Fe3+.
分析 氯气溶于水发生反应Cl2+H2O?HCl+HClO,新制氯水含有Cl2、H2O、HClO、H+、Cl-等粒子,其中H+可与碳酸钙等物质反应,而Cl2、HClO具有强氧化性,HClO具有漂白性,溶液中含有Cl-可与硝酸银反应生成白色AgCl沉淀,以此解答该题.
解答 解:(1)氯气为黄绿色气体,新制氯水呈现浅黄绿色,原因是溶解了Cl2,故答案为:Cl2;
(2)HClO不稳定,见光易分解,故答案为:HClO;
(3)溶液中含有Cl-,Cl-可与硝酸银反应生成白色AgCl沉淀,故答案为:Cl-;
(4)加入FeCl2溶液,发现很快变黄,原因是生成FeCl3,被氧化,说明氯气具有强氧化性,反应的离子方程式为2Fe2++Cl2=2Cl-+2Fe3+,故答案为:强氧化;2Fe2++Cl2=2Cl-+2Fe3+.
点评 本题综合考查氯气和氯水的性质,注意把握氯气和水反应的特点以及氯水的成分和性质,为高考高频考点,侧重于基础知识的综合运用,难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
13.下列事件表明有机化学成为一门独立化学分支的是( )
| A. | 1828年德国化学家维勒首次在实验室里合成了尿素 | |
| B. | 19世纪初,瑞典化学家贝采利乌斯首次使用“有机”一词,并提出了“有机化学”和“有机化合物”的概念 | |
| C. | 1965年我国科学家人工合成了具有生物活性的蛋白质--结晶牛胰岛素 | |
| D. | 1830年,德国化学家李比希创立了有机化合物的定量分析方法 |
14.化学与生产、生活密切联系.下列有关说法不正确的是( )
| A. | 网状结构的聚丙烯酸钠是高吸水性树脂,可用于制造“尿不湿” | |
| B. | 光导纤维应避免在强碱性环境中使用 | |
| C. | 利用超临界C02流体作为萃取溶剂符合绿色化学 | |
| D. | 船体镀锌或锡均可保护船体,镀层破损后将立即失去保护作用 |
11.若溶液中由水电离产生的C(OH-)=1×10-14 mol•L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A. | Al3+ Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- AlO2- | D. | K+ ClO- SO42- NO3- |
18.将21.75g MnO2粉末与80mL 10mol•L-1的浓盐酸混合,在密闭容器中加热使其充分反应后,可得到标况下的Cl2的体积(V)是( )
| A. | V=4.48 L | B. | V=5.6 L | C. | 4.48 L<V<5.6 L | D. | V<4.48 L |
15.下列对有关“物质的量与摩尔(mol)”的叙述正确的是( )
| A. | 摩尔是描述微观粒子多少的物理量 | |
| B. | 物质的量将可称量的宏观物质与一定数目微观粒子联系起来 | |
| C. | 1molO2的质量为32g•mol-1 | |
| D. | 22.4L H2的物质的量为1mol |
12.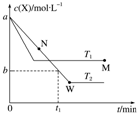 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )| A. | M点时再加入一定量X,平衡后X的转化率减小 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$ mol•L-1•min-1 | |
| C. | M点的正反应速率v正大于N点的逆反应速率v逆 | |
| D. | 该反应进行到M点放出的热量大于进行到W点放出的热量 |
13.阿伏加德罗常数约为6.02×1023 mol-1(NA),下列说法正确的是( )
| A. | 常温常压下,16g O2与16g O3所含的原子数均是NA | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA | |
| C. | 标准状况下,2.24LCCl4所含原子数为0.5NA | |
| D. | 标准状况下,22.4 L氦气所含有的质子数目约为4×6.02×1023 |
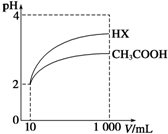 体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).