题目内容
8.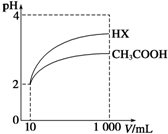 体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
分析 加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大.
解答 解:根据图知,pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,则HX的酸性大于醋酸,所以HX的电离平衡常数大于常数;
稀释后醋酸中氢离子浓度大于HX,所以醋酸抑制水电离程度大于HX,则HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+),
故答案为:大于;pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大;大于.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确影响弱电解质的电离平衡的因素为解答关键,注意掌握酸碱溶液对水的电离的影响,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
18.某矿石由前20号元素中的四种组成,其化学式为WYZX4.X、Y、Z、W分布在三个周期,原子序数依次增大,Y、W为金属元素,X原子的最外层电子数是次外层电子数的3倍,W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同一周期,Z单质是一种良好的半导体.则下列判断不正确的是( )
| A. | 原子半径:W>Y>Z>X | |
| B. | 气态氢化物的稳定性:Z<X | |
| C. | Y、Z的氧化物都有两性 | |
| D. | Y、W最高价氧化物对应水化物间可以相互反应 |
13.下列物质不属于盐的是( )
| A. | 纯碱 | B. | KClO3 | C. | 小苏打 | D. | Na2O2 |
20.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol固体氯化氨中存在离子数小于2NA | |
| B. | 标准状况下,22.4L己烷中共价键的数目为19NA | |
| C. | 标况下的NO2气体22.4L,其中含有的氮原子数为NA | |
| D. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA |
17.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法不正确的是( )
| A. | 负极反应式:Ag+Cl--e-═AgCl | |
| B. | AgCl是氧化产物 | |
| C. | 每生成1 mol Na2Mn5O10转移2 mol电子 | |
| D. | Na+不断向“水”电池的负极移动 |
 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
 .
.