题目内容
6.电子工业常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板.从腐蚀废液(主要含FeCl3、FeCl2、CuCl2 )中回收铜,并重新获得FeCl3溶液.废液处理流程如下: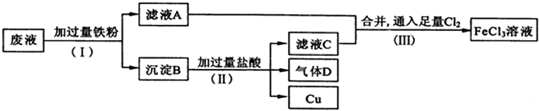
(1)步骤(Ⅰ)中分离溶液和沉淀的操作名称是过滤;
(2)沉淀B中主要含有铁和铜,气体D是氢气;
(3)写出步骤(Ⅲ)中生成FeCl3的化学方程式2FeCl2+Cl2=2FeCl3;
(4)取少量最终所得溶液滴加KSCN溶液(填“KSCN溶液”或“稀硫酸”),溶液呈红色,证明有Fe3+存在.
分析 从腐蚀废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,由流程可知,应加入过量的Fe与氯化铁、氯化铜反应生成氯化亚铁、铜,过滤进行分离,则滤液A为FeCl2,沉淀B中含Fe、Cu,加过量盐酸,铁溶解,产生氯化亚铁和氢气,过滤得到金属Cu,滤液C中含FeCl2、HCl,为不引人杂质,将铁的化合物全部转化为FeCl3溶液,则通入足量氯气进行氧化,据此解答.
解答 解:从腐蚀废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,由流程可知,应加入过量的Fe与氯化铁、氯化铜反应生成氯化亚铁、铜,过滤进行分离,则滤液A为FeCl2,沉淀B中含Fe、Cu,加过量盐酸,铁溶解,产生氯化亚铁和氢气,过滤得到金属Cu,滤液C中含FeCl2、HCl,为不引人杂质,将铁的化合物全部转化为FeCl3溶液,则通入足量氯气进行氧化.
(1)步骤(Ⅰ)中分离溶液和沉淀的操作名称是过滤,故答案为:过滤;
(2)由流程分析可知沉淀B中含过量的铁和产生的铜,铁与盐酸反应产生氢气,故答案为:铜;氢气;
(3)通入Cl2全部转化为FeCl3,发生反应:2FeCl2+Cl2=2FeCl3,故答案为:2FeCl2+Cl2=2FeCl3;
(4)检验溶液中Fe3+存在通常用KSCN溶液,溶液变红说明Fe3+存在,故答案为:KSCN溶液.
点评 本题考查混合物的分离、提纯综合应用,明确工艺流程原理,掌握元素化合物的性质是关键,题目较简单.

练习册系列答案
相关题目
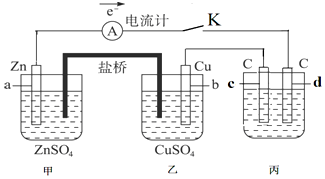
14.结合如图判断,下列叙述正确的是( )
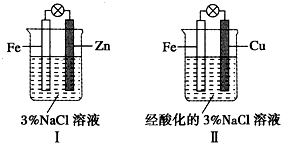

| A. | Ⅰ是验证牺牲阳极的阴极保护法的实验装置 | |
| B. | Ⅰ和Ⅱ中负极反应式均是:Fe-2e-=Fe2+ | |
| C. | Ⅰ和Ⅱ中正极反应式均是:2H++2e-=H2 | |
| D. | Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
1.观察下列几个装置示意图,有关叙述正确的是( )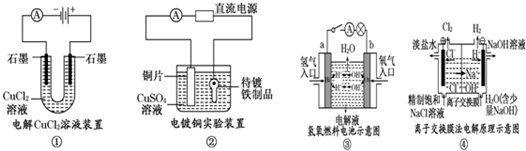

| A. | 装置①中阳极上析出红色固体 | |
| B. | 装置②的待镀铁制品应与电源负极相连 | |
| C. | 装置③中外电路电子由a极流向b极 | |
| D. | 装置④的阳极反应为:2H++2e-=H2↑ |
18.已知:H2、CO、CH4、C3H8 的燃烧热分别是285.8kJ/mol、283.0kJ/mol、890.3kJ/mol、2220.0kJ/mol,则等质量的这几种气体燃烧,产生热量最多的是( )
| A. | C3H8 | B. | CO | C. | H2 | D. | CH4 |
16.在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品,用如图中的实验装置进行实验,证明过氧化钠可用作供氧剂.
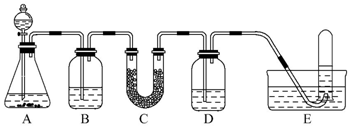
(1)A是制取CO2的装置.写出A中发生反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)填写表中空格:
(3)写出Na2O2与CO2反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
(4)试管中收集满气体后,下一步实验操作及现象、结论是把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管;把带火星的木条伸入试管内,木条复燃,证明管中收集的气体是O2.

(1)A是制取CO2的装置.写出A中发生反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去CO2中混有的HCl |
| C | ||
| D |
(4)试管中收集满气体后,下一步实验操作及现象、结论是把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管;把带火星的木条伸入试管内,木条复燃,证明管中收集的气体是O2.

 .
. .
. .
.