题目内容
15.“鸟巢”被评为2008年世界最具影响力的十大建筑之一.合金钢Q460是支撑“鸟巢”的铁骨钢筋,除含有铁元素外,还含有Mn(锰)、Ti(钛)、Cr(铬)、Nb(铌)等元素.下列有关说法正确的是( )| A. | Fe位于元素周期表的第四周期ⅧB族 | |
| B. | ${\;}_{22}^{46}$TiO2、${\;}_{22}^{48}$TiO2、${\;}_{22}^{50}$TiO2互为同位素 | |
| C. | 工业上利用热还原法冶炼金属Fe | |
| D. | ${\;}_{41}^{92}Nb$3+原子核内有51个中子,核外有41个电子 |
分析 A.铁位于元素周期表的第四周期第Ⅷ族;
B.同位素研究的对象是原子;
C.中子数=质量数-质子数,阳离子核外电子数=质子数-所带电荷数;
D.黑色金属材料通常包括铁、铬、锰以及它们的合金.
解答 解:A.铁位于元素周期表的第四周期第Ⅷ族,故A错误;
B.同位素研究的对象是原子,2246TiO2、2248TiO2、2250TiO2都是化合物,为同一物质,故B错误;
C.黑色金属材料通常包括铁、铬、锰以及它们的合金,故C正确;
D.原子核内有电子数为92-51=41,核外电子数为41-3=38,故D错误;
故选C.
点评 本题考查结构位置关系、原子结构、同位素、金属分类等,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
相关题目
6.下列叙述正确的是( )
| A. | 等浓度的氨水与氯化铵溶液中,前者c(NH${\;}_{4}^{+}$)大 | |
| B. | CH3COONa溶液中滴加少量浓盐酸后,水电离程度增大 | |
| C. | 向Na2CO3溶液中加入NaOH溶液后,c(CO${\;}_{3}^{2-}$)增大 | |
| D. | 室温时AgCl分别加入水中与AgNO3溶液中,前者溶度积常数大 |
3.关于如图各装置图的叙述中,正确的是( )
| A. |  制取氨气 制取氨气 | |
| B. |  可用于制备氢氧化亚铁并观察其颜色 可用于制备氢氧化亚铁并观察其颜色 | |
| C. |  X若为四氯化碳,可用于吸收氨气,并防止倒吸 X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| D. |  原电池,锌电极为负极,发生还原反应 原电池,锌电极为负极,发生还原反应 |
20.某有机物的结构简式为  .下列关于该有机物的叙述不正确的是( )
.下列关于该有机物的叙述不正确的是( )
 .下列关于该有机物的叙述不正确的是( )
.下列关于该有机物的叙述不正确的是( )| A. | 能与金属钠发生反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 在浓H2SO4催化下能与乙酸发生酯化反应 | |
| D. | 具有酸性,可以与氢氧化钠溶液反应 |
5.下列化学用语错误的是( )
| A. | 钠的原子结构示意图: | B. | 异丁烷的结构简式: | ||
| C. | 氯化氢的电子式: | D. | 羟基的化学式:OH- |
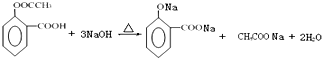
 ;含有的化学键类型有离子键和共价键.
;含有的化学键类型有离子键和共价键.
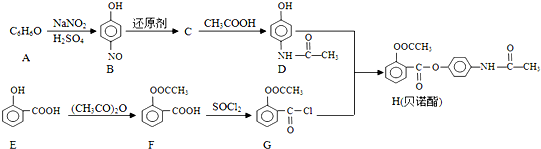
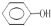 ;E中含氧官能团的名称为羟基、羧基.
;E中含氧官能团的名称为羟基、羧基.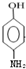 .
. .
.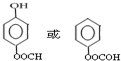 .
.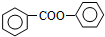 的合成路线流程图(无机试剂可任选):
的合成路线流程图(无机试剂可任选):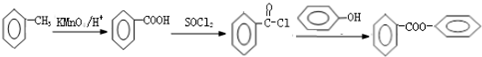 .
.