题目内容
16.有机物M的结构简式如图所示.下列说法中正确的是( )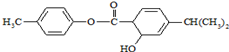
| A. | M中不含手性碳原子 | |
| B. | M中所有碳原子均可能在同一平面 | |
| C. | M可以发生加成、取代、消去等反应 | |
| D. | 1mol M常温下最多可以与3molNaOH反应 |
分析 由结构可知,分子中含-COOC-、-OH、碳碳双键,结合酯、醇、烯烃的性质来解答.
解答 解:A.与-OH相连的C连接4个不同基团,为手性碳原子,故A错误;
B.与-OH相连C、-CH(CH3)2中C均为四面体构型,所有C原子不可能共面,故B错误;
C.含碳碳双键可发生加成反应、含-COOC-可发生取代反应,含-OH可发生取代、消去反应,故C正确;
D.-COOC-及水解生成的酚-OH与NaOH反应,则1mol M常温下最多可以与2molNaOH反应,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质及应用,题目难度不大.

练习册系列答案
相关题目
6.俄国化学家制出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑.这位化学家是( )
| A. | 汤姆生 | B. | 道尔顿 | C. | 拉瓦锡 | D. | 门捷列夫 |
7.常温常压下,下列气体能用瓶口向下排空气法收集的是( )
| A. | CO2 | B. | NO2 | C. | Cl2 | D. | H2 |
4.根据离子方程式【】+XO${\;}_{3}^{-}$+6H+═3X2+3H2O判断,下列说法正确的是( )
| A. | X2的电子式为?X??X? | B. | X位于元素周期表中第ⅤA族 | ||
| C. | X元素原子的最外层有7个电子 | D. | X可能位于元素周期表中第二周期 |
11.电池是人类生产和生活中的重要的能量来源,各式各样电池的发明是化学对人类的一项重大贡献.下列有关电池的叙述正确的是( )
| A. | 构成电池的两极必须是活泼性不同的金属 | |
| B. | 锌锰干电池工作时,锌作负极 | |
| C. | 在电池中,电子流出的一极是负极,发生还原反应 | |
| D. | 银锌纽扣电池工作时,电子由锌极流出经过溶液后流向银极 |
8.A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如表:
(1)元素Y是C下一周期同主族元素,比较B、Y元素的第一电离能I1(B)>I1(Y)(填“>”“=”或“<”);
(2)盐X的水溶液呈酸性(填“酸性”“碱性”或“中性”),原因NH4++H2O?NH3•H2O+H+(用离子方程式表示);
(3)E元素原子的核外电子排布式为1s22s22p63s23p63d64s2,在周期表中的位置第四周期Ⅷ族;
(4)C单质分子中σ键和π键的个数比为1:2,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是NH3分子间存在氢键;
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式: ,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物水化物的酸性为同主族最强 |
| E | E元素的核电荷数等于A原子的核电荷数和B元素氢化物的核电荷数之和 |
(2)盐X的水溶液呈酸性(填“酸性”“碱性”或“中性”),原因NH4++H2O?NH3•H2O+H+(用离子方程式表示);
(3)E元素原子的核外电子排布式为1s22s22p63s23p63d64s2,在周期表中的位置第四周期Ⅷ族;
(4)C单质分子中σ键和π键的个数比为1:2,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是NH3分子间存在氢键;
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式:
 ,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
5.已知25℃时有关弱酸的电离平衡常数如下表,下列有关说法正确的是( )
| 弱酸化学式 | CH3 COOH | HCN | H2 CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | Na2CO3和NaHCO3等物质的量混合的溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 0.4mol/L HCN溶液与0.2mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-)>c(OH-)>c(H+) | |
| D. | 25℃时,浓度均为0.1mol/L的CH3COONa、CH3COOH混合溶液中:c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH) |
6.下列各组离子在指定的溶液中一定能大量共存的是( )
| A. | 漂白粉的水溶液中:Fe2+、K+、Ca2+、Br- | |
| B. | pH=0的溶液中:Cu2+、Cl-、SO${\;}_{4}^{2-}$、Na+ | |
| C. | 含大量NO3-的溶液:Fe3+、Al3+、SO32-、H+ | |
| D. | 能够与金属Al常温下反应放出气体的溶液:HCO${\;}_{3}^{-}$、Na+、Ca2+、Cl- |
 早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:
早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题: