题目内容
4.根据离子方程式【】+XO${\;}_{3}^{-}$+6H+═3X2+3H2O判断,下列说法正确的是( )| A. | X2的电子式为?X??X? | B. | X位于元素周期表中第ⅤA族 | ||
| C. | X元素原子的最外层有7个电子 | D. | X可能位于元素周期表中第二周期 |
分析 根据离子方程式左右电荷相等,则未知物应含有5个负电荷,根据方程式遵循质量守恒定律可知,如生成3molX2,则XO3-为1mol,未知物为5mol,所以1mol未知物含有1mol负电荷,即X的最低化合价为-1价,最X原子核外有7个电子,最高化合价为+7价,以此解答该题.
解答 解:根据离子方程式左右电荷相等,则未知物应含有5个负电荷,
根据方程式遵循质量守恒定律可知,如生成3molX2,则XO3-为1mol,未知物为5mol,
所以1mol未知物含有1mol负电荷,即X的最低化合价为-1价,
最X原子核外有7个电子,最高化合价为+7价.
A.X的最外层有7个电子,X-X之间有1对共用电子对,故A错误;
B.X原子核外有7个电子,应位于周期表第ⅦA族,故B错误;
C.由以上分析可知,X元素的原子最外电子层上有7个电子,故C正确;
D.X可为Cl、Br、I等元素,不为第二周期元素,故D错误.
故选:C.
点评 本题考查原子结构与元素的性质,侧重于离子方程式的书写和推断,题目难度中等,注意从守恒的角度解答,解答本题的关键是正确推断未知物的物质的量和化合价.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
14.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述正确的是( )
| A. | 植物油不能使溴的四氯化碳溶液褪色 | |
| B. | 葡萄糖能发生水解反应 | |
| C. | 淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖 | |
| D. | 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
12.已知Cl、S、P为三种原子序数相连的元素,则下列说法正确的是( )
| A. | 气态氢化物的稳定性:HCl>H2S>PH3 | B. | 非金属活泼性:S<Cl<P | ||
| C. | 原子半径:Cl>S>P | D. | 原子序数:S<P<Cl |
19.如表是元素周期表的一部分,针对表中的①~⑩元素,回答下列问题:
(1)在这些元素中,非金属性最强的元素符号是F;
(2)⑧元素的氢化物的化学式为SiH4;
(3)金属性最活泼的元素的原子结构示意图为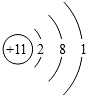 ;
;
(4)能用来雕刻玻璃的氢化物的化学式是HF;
(5)④、⑨、⑩三种元素的原子半径由大到小的排列顺序为S>Cl>F(用元素符号表示);
(6)写出③元素的气态氢化物和⑨元素的最高价氧化物对应水化物相互反应的化学方程式2NH3+H2SO4=(NH4)2SO4;
(7)在⑤、⑥、⑦三种元素中,最高价氧化物对应的水化物的碱性最强的是NaOH(用化学式表示);
(8)能证明元素⑩比元素⑨的非金属性强的事实是BC(填序号).
A.常温下⑩单质的密度小于⑨单质的密度
B.⑩元素的气态氢化物比⑨元素的气态氢化物更稳定
C.⑩单质与氢气反应的程度比⑨单质与氢气反应的程度更剧烈
D.⑨元素的最高价氧化物对应的水化物酸性强于⑩元素的最高价氧化物对应的水化物.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)⑧元素的氢化物的化学式为SiH4;
(3)金属性最活泼的元素的原子结构示意图为
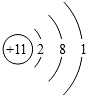 ;
;(4)能用来雕刻玻璃的氢化物的化学式是HF;
(5)④、⑨、⑩三种元素的原子半径由大到小的排列顺序为S>Cl>F(用元素符号表示);
(6)写出③元素的气态氢化物和⑨元素的最高价氧化物对应水化物相互反应的化学方程式2NH3+H2SO4=(NH4)2SO4;
(7)在⑤、⑥、⑦三种元素中,最高价氧化物对应的水化物的碱性最强的是NaOH(用化学式表示);
(8)能证明元素⑩比元素⑨的非金属性强的事实是BC(填序号).
A.常温下⑩单质的密度小于⑨单质的密度
B.⑩元素的气态氢化物比⑨元素的气态氢化物更稳定
C.⑩单质与氢气反应的程度比⑨单质与氢气反应的程度更剧烈
D.⑨元素的最高价氧化物对应的水化物酸性强于⑩元素的最高价氧化物对应的水化物.
9.常温下,将下列物质溶于水分别配成0.1mol.L-1溶液,所得溶液pH大于7的是( )
| A. | NaCl | B. | HCl | C. | CH3COONa | D. | NH4Cl |
16.有机物M的结构简式如图所示.下列说法中正确的是( )
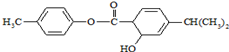

| A. | M中不含手性碳原子 | |
| B. | M中所有碳原子均可能在同一平面 | |
| C. | M可以发生加成、取代、消去等反应 | |
| D. | 1mol M常温下最多可以与3molNaOH反应 |
13.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 实验室从海带中提取单质碘的方法是取样→灼烧→溶解→过滤→萃取 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 为了增加食物的营养成分,可以大量使用食品添加剂 | |
| D. | 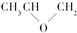 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物 ,该反应符合绿色化学的原则 ,该反应符合绿色化学的原则 |
14.设NA为阿伏伽德罗常数值.下列有关叙述正确的是( )
| A. | 14g乙烯和丙烯混合气体中的氢原子数为2 NA | |
| B. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| C. | 18g水中含有2NA个氢键 | |
| D. | 标准状况下,2.24LCCl4含有的共价键数为0.4NA |