题目内容
8.A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如表:| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物水化物的酸性为同主族最强 |
| E | E元素的核电荷数等于A原子的核电荷数和B元素氢化物的核电荷数之和 |
(2)盐X的水溶液呈酸性(填“酸性”“碱性”或“中性”),原因NH4++H2O?NH3•H2O+H+(用离子方程式表示);
(3)E元素原子的核外电子排布式为1s22s22p63s23p63d64s2,在周期表中的位置第四周期Ⅷ族;
(4)C单质分子中σ键和π键的个数比为1:2,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是NH3分子间存在氢键;
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式:
 ,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
分析 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9%,则A为氧元素,B原子得到一个电子后3p轨道全充满,则B为氯元素,C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X,则C为氮元素,X为硝酸铵,D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体,且为前四周期元素,所以D为碳元素,E元素的核电荷数等于A原子核、B元素氢化物的核电荷数之和,则E为铁元素,故A~E分别为O、Cl、N、C和Fe,据此答题.
解答 解:负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9%,则A为氧元素,B原子得到一个电子后3p轨道全充满,则B为氯元素,C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X,则C为氮元素,X为硝酸铵,D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体,且为前四周期元素,所以D为碳元素,E元素的核电荷数等于A原子核、B元素氢化物的核电荷数之和,则E为铁元素,故A~E分别为O、Cl、N、C和Fe,
(1)元素Y是C下一周期同主族元素,则Y为P元素,而B为Cl元素,根据元素周期律,P的第一电离能小于Cl的第一电离能,故答案为:>;
(2)盐X为NH4NO3,属强酸弱碱盐,因水解而显酸性;离子反应的方程式为:NH4++H2O?NH3•H2O+H+,故答案为:酸性;NH4++H2O?NH3•H2O+H+;
(3)Fe为26号元素,其核外电子排布式为1s22s22p63s23p63d 64s2,在周期表中的位置为:第四周期Ⅷ族,故答案为:1s22s22p63s23p63d 64s2;第四周期Ⅷ族
;
(4)C单质为N2,N2分子含氮氮三键,δ键和π键的个数比为1:2;由于氨分子间存在氢键,故使其沸点出现反常,故答案为:1:2; NH3分子间存在氢键;
(5)H2A为H2O,H2O释放出一个电子生成H2O+其中氧元素为-1价,其电子式为 ,具有强氧化性,可以氧化H2S,其离子方程式为 2H2O++H2S=S↓+2H2O+2H+,故答案为:
,具有强氧化性,可以氧化H2S,其离子方程式为 2H2O++H2S=S↓+2H2O+2H+,故答案为: ;2H2O++H2S=S↓+2H2O+2H+.
;2H2O++H2S=S↓+2H2O+2H+.
点评 本题主要考查了第一电离能、电子排布式、化学键、电子式、离子反应等知识点,中等难度,解题关键要充分运用题中的信息.

| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)⑧元素的氢化物的化学式为SiH4;
(3)金属性最活泼的元素的原子结构示意图为
 ;
;(4)能用来雕刻玻璃的氢化物的化学式是HF;
(5)④、⑨、⑩三种元素的原子半径由大到小的排列顺序为S>Cl>F(用元素符号表示);
(6)写出③元素的气态氢化物和⑨元素的最高价氧化物对应水化物相互反应的化学方程式2NH3+H2SO4=(NH4)2SO4;
(7)在⑤、⑥、⑦三种元素中,最高价氧化物对应的水化物的碱性最强的是NaOH(用化学式表示);
(8)能证明元素⑩比元素⑨的非金属性强的事实是BC(填序号).
A.常温下⑩单质的密度小于⑨单质的密度
B.⑩元素的气态氢化物比⑨元素的气态氢化物更稳定
C.⑩单质与氢气反应的程度比⑨单质与氢气反应的程度更剧烈
D.⑨元素的最高价氧化物对应的水化物酸性强于⑩元素的最高价氧化物对应的水化物.
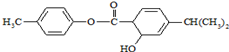
| A. | M中不含手性碳原子 | |
| B. | M中所有碳原子均可能在同一平面 | |
| C. | M可以发生加成、取代、消去等反应 | |
| D. | 1mol M常温下最多可以与3molNaOH反应 |
| A. | 实验室从海带中提取单质碘的方法是取样→灼烧→溶解→过滤→萃取 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 为了增加食物的营养成分,可以大量使用食品添加剂 | |
| D. |  和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物 ,该反应符合绿色化学的原则 ,该反应符合绿色化学的原则 |
| A. | NaCl | B. | H2O | C. | K2O | D. | NaOH |
