题目内容
9.有一包白色粉末,可能含有①NaHSO4、②KHCO3、③Ba(NO3)2、④CaCl2、⑤NaNO3、⑥MgSO4中的一种或几种.实验步骤如下:①取少量固体投入水中,既有气体又有沉淀产生.
②过滤,取少量滤液加AgNO3溶液,无沉淀产生.
③再取少量滤液,加入足量NaOH溶液,也无沉淀产生.
(1)推断白色粉末中一定有①②③,一定没有④⑥,不能肯定有没有的是⑤.(填序号,选错倒扣分,扣完为止,不出现负分.)
(2)请写出实验步骤①中产生气体的离子方程式:H++HCO3-=H2O+CO2↑.
(3)请写出实验步骤①中产生沉淀的离子方程式:SO42-+Ba2+=BaSO4↓ .
分析 ①取少量固体投入水中,既有气体又有沉淀产生.说明生成气体的一定是CO2;生成沉淀的可能是硫酸钡或碳酸钙;
②过滤,取少量滤液加AgNO3溶液,无沉淀产生,证明不含氯离子,一定不含④CaCl2,可能不含⑥MgSO4;
③再取少量滤液,加入足量NaOH溶液,也无沉淀产生,证明一定不含⑥MgSO4,以此来解答.
解答 解:由①取少量固体投入水中,既有气体又有沉淀产生.说明生成气体的一定是CO2,则白色粉末一定含②KHCO3、①NaHSO4;生成沉淀的可能是硫酸钡或碳酸钙,则可能含③Ba(NO3)2、④CaCl2中的一种或两种;
②过滤,取少量滤液加AgNO3溶液,无沉淀产生,证明不含氯离子,一定不含④CaCl2,可能不含⑥MgSO4;
③再取少量滤液,加入足量NaOH溶液,也无沉淀产生,证明一定不含⑥MgSO4;
综上所述:一定含有①NaHSO4 ②KHCO3 ③Ba(NO3)2;一定不含④CaCl2 ⑥MgSO4;可能含有⑤NaNO3;
(1)由上述分析可知,白色粉末中一定有①②③,一定没有④⑥,可能含有⑤,故答案为:①②③;④⑥;⑤;
(2)实验步骤①中产生气体是二氧化碳,反应的离子方程式为H++HCO3-=H2O+CO2↑,
故答案为:H++HCO3-=H2O+CO2↑;
(3)实验步骤①中产生沉淀是硫酸钡,反应的离子方程式为:SO42-+Ba2+=BaSO4↓,
故答案为:SO42-+Ba2+=BaSO4↓.
点评 本题考查无机物的推断,为高频考点,把握元素化合物性质、发生的反应为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
17. 如图表示4个碳原子相互结合的几种方式.小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合,则下列说法正确的是( )
如图表示4个碳原子相互结合的几种方式.小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合,则下列说法正确的是( )
 如图表示4个碳原子相互结合的几种方式.小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合,则下列说法正确的是( )
如图表示4个碳原子相互结合的几种方式.小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合,则下列说法正确的是( )| A. | 图中属于烷烃的是A、C、H | |
| B. | 图中C和F分子中氢原子数相同 | |
| C. | 图中物质碳元素的质量分数最大的是C | |
| D. | 图中与B互为同分异构体的有E、F、H |
14.下列说法中不正确的是( )
| A. | 分子式为C4H10O并能与金属钠反应放出氢气的有机化合物有5种 | |
| B. | 反应2H2(g)+O2(g)═2H2O(l)变化过程中,熵在减小(即△S<O) | |
| C. | 乙烯和1,3-丁二烯的混合气体1 L,催化剂存在下与足量氢气发生加成反应,消耗1.4 L氢气,则原混合气体中乙烯和1,3-丁二烯的体积比为:3:2 | |
| D. | 可用氢氧化钠溶液、银氨溶液和碘水检验淀粉溶液是否是部分发生水解 |
18.下列分析及判断中正确的是( )
| A. | 常温下0.1mol•L-1醋酸溶液pH=a,将溶液稀释到原体积的10倍pH=a+1 | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012溶液中:NH4+、Al3+、NO3-、Cl-可以大量共存 | |
| C. | CO2分子中,碳氧键为极性键,正电荷中心和负电荷中心不重合,为极性分子 | |
| D. | pH=8.0的溶液中,CO2的主要存在形态为CO32- |
5.下列各组离子在溶液中能大量共存的是( )
| A. | NH4+ SO42- NO3- | B. | Ba2+ SO42- NO3- | ||
| C. | Na+ H+ CO32- | D. | Cu2+ OH- Cl- |

 .
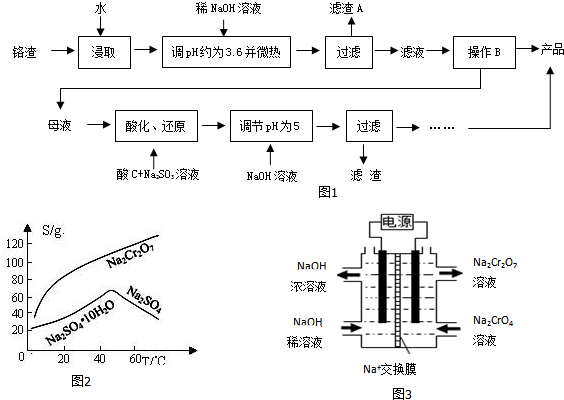
.
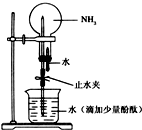 有关氨的实验室制取和性质实验如下:
有关氨的实验室制取和性质实验如下: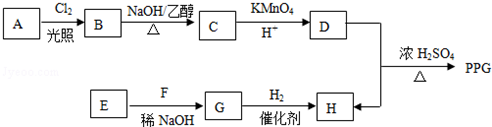
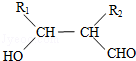
 .
. .
. .
. (写构简式)
(写构简式)