题目内容
化学与科学、技术、社会、环境密切相关.下列叙述正确的是( )
| A、普通玻璃的主要成分是纯碱、石灰石和二氧化硅 |
| B、标准状况下,1 mol Na2O2和22.4LSO2反应,转移电子数目为2NA |
| C、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
| D、C、S分别在空气中燃烧均可得到两种不同的氧化物 |
考点:玻璃的主要化学成分、生产原料及其用途,阿伏加德罗常数,氯、溴、碘及其化合物的综合应用,镁、铝的重要化合物
专题:
分析:A.制造普通玻璃的原料是:纯碱、石灰石和石英;
B.1 mol Na2O2和22.4LSO2恰好反应生成Na2SO4,反应中只有S元素的化合价升高,由+4价升高为+6价,转移电子物质的量是SO2的2倍;
C.明矾的漂白原理是利用铝离子水解生成的氢氧化铝胶体的吸附性,漂白粉漂白原理是利用了次氯酸钙的强氧化性;
D.S在氧气中点燃只能生成二氧化硫;
B.1 mol Na2O2和22.4LSO2恰好反应生成Na2SO4,反应中只有S元素的化合价升高,由+4价升高为+6价,转移电子物质的量是SO2的2倍;
C.明矾的漂白原理是利用铝离子水解生成的氢氧化铝胶体的吸附性,漂白粉漂白原理是利用了次氯酸钙的强氧化性;
D.S在氧气中点燃只能生成二氧化硫;
解答:
解:A.制造普通玻璃的原料是:纯碱、石灰石和石英;普通玻璃化学氧化物的组成(Na2O?CaO?6SiO2),主要成份是二氧化硅,故A错误;
B.1 mol Na2O2和22.4LSO2恰好反应生成Na2SO4,反应中只有S元素的化合价升高,由+4价升高为+6价,转移电子物质的量是SO2的2倍,转移电子物质的量为1mol×2=2mol,故B正确;
C.明矾的漂白原理是利用铝离子水解生成的氢氧化铝胶体的吸附性,漂白粉漂白原理是利用了次氯酸钙的强氧化性,两者的作用原理不相同,故C错误;
D.S在氧气中点燃只能生成二氧化硫,C在氧气中点燃可能得到两种不同的氧化物CO、CO2,故D错误;
故选B.
B.1 mol Na2O2和22.4LSO2恰好反应生成Na2SO4,反应中只有S元素的化合价升高,由+4价升高为+6价,转移电子物质的量是SO2的2倍,转移电子物质的量为1mol×2=2mol,故B正确;
C.明矾的漂白原理是利用铝离子水解生成的氢氧化铝胶体的吸附性,漂白粉漂白原理是利用了次氯酸钙的强氧化性,两者的作用原理不相同,故C错误;
D.S在氧气中点燃只能生成二氧化硫,C在氧气中点燃可能得到两种不同的氧化物CO、CO2,故D错误;
故选B.
点评:本题考查较为综合,涉及普通玻璃的主要成分、氧化还原反应计算、明矾和漂白粉漂白原理、C、S化学性质等,是对基础知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某同学通过系列实验,探究Cu及其化合物的性质,操作正确且能达到目的是( )
| A、将铜粉和硫粉混合均匀并加热以制取CuS |
| B、将Cu片放入过量浓硫酸中,一段时间后加水以观察CuSO4溶液的颜色 |
| C、向CuSO4溶液中加入NaOH溶液,过滤洗涤并收集沉淀,加热以制取CuO |
| D、设计Cu-Al-浓硝酸原电池,以证明金属活动性:Cu<Al |
将0.1mol?L-1的盐酸逐滴加入体积与物质的量浓度均相等的甲、乙、丙三种溶液中,当溶液呈中性时,消耗盐酸的体积大小顺序为( )
| 甲 | 乙 | 丙 |
| 氨水 | KOH | K2CO3 |
| A、甲>乙>丙 |
| B、乙>甲>丙 |
| C、丙>乙>甲 |
| D、丙>甲>乙 |
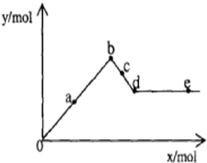 已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )| A、d-e 时溶液中离子的物质的量:Ba2+可能等于AlO2- |
| B、b-c 时溶液中离子的物质的量:AlO2-比Ba2+多 |
| C、a-d 时沉淀的物质的量:Al(OH)3一定小于BaSO4 |
| D、a-b 时沉淀的物质的量:Al(OH)3比BaSO4多 |
少量铁粉与100mL 0.01mol?L-1的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的①加H2O ②加CH3COONa固体 ③改用10mL 0.1mol?L-1盐酸 ④滴入几滴硫酸铜溶液
⑤升高温度(不考虑盐酸挥发)( )
⑤升高温度(不考虑盐酸挥发)( )
| A、①② | B、②③ | C、③⑤ | D、④⑤ |
CaH2常作为生氢剂,其中氢元素呈-1价,其化学方程式为CaH2+2H2O═Ca(OH)2+2H2↑,其中水是( )
| A、还原剂 |
| B、氧化剂 |
| C、既是还原剂又是氧化剂 |
| D、既不是氧化剂又不是还原剂 |