题目内容
8.铜在生产生活中发挥着重要作用,以黄铜矿(主要成分是CuFeS2,含铜量约为1%)为原料冶炼铜的流程如图所示.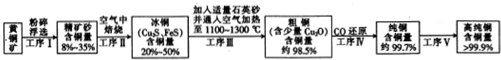
(1)工作Ⅱ涉及的主要反应过程如下:
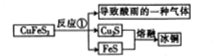
则反应①的化学方程式为2CuFeS2+O2$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S+2FeS+SO2.
(2)工序Ⅲ中所加入石英砂的主要成分是SiO2,加入适量石英砂的目的是FeSiO3.
(3)检验粗铜中含有少量Cu2O的方法是取少量粗铜与烧杯中,加入适量稀硫酸,若溶液变蓝色,则说明含有Cu2O.
(4)工序Ⅴ生产方法的名称是电解精炼.
(5)冶炼过程中的废气回收后,可用于制备硫酸,其中一步反应是二氧化硫的催化氧化,催化氧化之前对SO2和空气的混合气体进行净化的目的是除去混合气体中的有害杂质,防止催化剂中毒;催化氧化通常在常压(填“常压”或“高压”)条件下进行,合成硫酸时,选用98%浓硫酸进入吸收塔吸收SO2,原因是避免形成酸雾,有利于三氧化硫吸收.
分析 黄铜矿粉碎浮选然后得到精矿砂,精矿砂在空气中焙烧得到冰铜,将冰铜和石英砂高温加热得到粗铜,粗铜和CO还原得到纯铜,然后将纯铜通过工序V得到高纯铜,
(1)工作Ⅱ涉及的主要反应过程如下:
黄铜矿和空气加热得到含有导致酸雨的一种气体SO2,同时得到Cu2S、FeS,将这两种硫化物熔融得到冰铜;
根据反应物和生成物及反应条件书写方程式;
(2)工序Ⅲ中所加入石英砂的主要成分是SiO2,二氧化硅能和碱性氧化物反应生成盐;
(3)Cu和稀硫酸不反应,但Cu2O能和稀硫酸反应生成CuSO4和Cu;
(4)电解精炼粗铜可以得到纯铜;
(5)二氧化硫在催化氧化生成三氧化硫过程中,催化剂易中毒;
催化氧化通常在常压条件下进行,合成硫酸时,选用98%浓硫酸进入吸收塔吸收SO2,然后再稀释得到其它浓度的硫酸.
解答 解:黄铜矿粉碎浮选然后得到精矿砂,精矿砂在空气中焙烧得到冰铜,将冰铜和石英砂高温加热得到粗铜,粗铜和CO还原得到纯铜,然后将纯铜通过工序V得到高纯铜,
(1)工作Ⅱ涉及的主要反应过程如下:
黄铜矿和空气加热得到含有导致酸雨的一种气体SO2,同时得到Cu2S、FeS,将这两种硫化物熔融得到冰铜;
根据反应物和生成物及反应条件书写方程式为2CuFeS2+O2$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S+2FeS+SO2,
故答案为:2CuFeS2+O2$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S+2FeS+SO2;
(2)工序Ⅲ中所加入石英砂的主要成分是SiO2,二氧化硅能和碱性氧化物反应生成盐,所以加入石英砂的目的是与FeO反应形成炉渣FeSiO3,
故答案为:SiO2;FeSiO3;
(3)Cu和稀硫酸不反应,但Cu2O能和稀硫酸反应生成CuSO4和Cu,所以反应后溶液呈蓝色,则如果溶液变蓝色,则说明含有Cu2O,
故答案为:取少量粗铜与烧杯中,加入适量稀硫酸,若溶液变蓝色,则说明含有Cu2O;
(4)电解精炼粗铜可以得到纯铜,所以其操作名称是电解精炼,故答案为:电解精炼;
(5)二氧化硫在催化氧化生成三氧化硫过程中,催化剂易中毒,从而失去活性,为防止催化剂中毒,则催化氧化之前对SO2和空气的混合气体进行净化;
催化氧化通常在常压条件下进行,因为增大压强促进三氧化硫的生成,但对设备要求更高,合成硫酸时,选用98%浓硫酸进入吸收塔吸收SO2,然后再稀释得到其它浓度的硫酸,防止产生酸雾,
故答案为:除去混合气体中的有害杂质,防止催化剂中毒;常压;98%浓硫酸;避免形成酸雾,有利于三氧化硫吸收.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生分析判断及知识综合运用能力,涉及物质检验、金属冶炼、氧化还原反应等知识点,明确流程图中反应原理、元素化合物性质是解本题关键,题目难度不大.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| A. | 标准状况下,11.2LC5H12含有的分子数为0.5NA | |
| B. | 21g乙烯与丁烯的混合气体中含有3NA个C-H键 | |
| C. | 1L0.1mol/LNH4NO3溶液中含有0.2NA个N | |
| D. | 光照下,1molCl2与足量CH4完全反应,生成NA个HCl |
| A. | 1.7克-OH中含有的电子数为NA | |
| B. | 42g乙烯与丙烯的混合气体中含碳原子数为3NA | |
| C. | 二氯乙烯的结构简式:CH2=C(Cl)2 | |
| D. | 乙烯和乙醇的混合物共0.1mol,完全燃烧所消耗的氧气的分子数一定为0.6 NA |
| A. | 蒸馏“地沟油”可以获得汽油 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 高纯度的二氧化硅广泛应用于制作光导纤维,光导纤维遇强碱会“断路” |
| A. | 硅胶疏松多孔,可用作催化剂的载体 | |
| B. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| C. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 | |
| D. | 氮的固定只有在高温、高压、催化剂的条件下才能实现 |
| A. | 若x=y,且a+b=14,则pH>7 | B. | 若10x=y,且a+b=13,则pH=7 | ||
| C. | 若ax=by,且a+b=14,则pH=7 | D. | 若x=10y,且a+b=14,则pH>7 |
| A | ①能使溴的四氯化碳溶液褪色; ②填充模型为 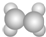 ; ;③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型为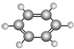 |
| C | ①由C、H、18O三种元素组成,分子中原子个数比为2:6:1;②能与Na反应,但不能 与NaOH溶液反应;③能与D反应生成相对分子质量为90的酯 |
| D | ①由C、H、O三种元素组成; ②球棍模型为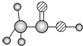 |
(1)B在50~60℃时,能与混酸(浓硫酸和浓硝酸的混合溶液)反应,其化学方程式为
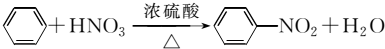
(2)写出C与D反应的化学方程式:CH3COOH+CH3CH218OH
 CH3CO18OCH2CH3+H2O
CH3CO18OCH2CH3+H2O(3)写出A与溴的四氯化碳溶液反应的化学方程式:CH2=CH2+Br2→CH2BrCH2Br
(4)C能在铜的作用下与O2反应,写出反应的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
| A. | 只要是氧化还原反应原理都可以设计成原电池 | |
| B. | Cu+2H+═Cu2++H2↑在任何条件下都不能进行 | |
| C. | 金属的防护可以采取制成合金,改变内部结构的方法 | |
| D. | 现代潜艇的防腐是在潜艇底部贴锌板 |