题目内容
9.在沸腾炉中进行反应时,被氧化的元素是( )| A. | 只有硫 | B. | 只有铁 | C. | 硫和铁 | D. | 硫和氧 |
分析 沸腾炉中硫铁矿与氧气反应的化学方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,氧化还原反应中化合价升高被氧化,结合该反应中元素化合价变化进行判断.
解答 解:沸腾炉中二硫化亚铁能与氧气高温反应生成氧化铁和二氧化硫:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,
反应中亚铁离子从而+2变为+3,化合价升高被氧化;硫元素的化合价是-1价,在二氧化硫中硫元素的化合价是+4价,S元素由-1变为+4被氧化,
所以该反应中被氧化的元素为硫和铁,
故选C.
点评 本题考查了氧化还原反应,题目难度不大,明确氧化还原反应特征为解答关键,注意掌握氧化反应、还原反应与元素化合价变化的关系.

练习册系列答案
相关题目
19.全球环境问题按其相对的严重性排在前三位的是( )
| A. | 饮用水污染问题,土壤荒漠化问题,噪声污染问题 | |
| B. | 海洋污染问题,土壤荒漠化问题,物种灭绝 | |
| C. | 森林面积减少,饮用水污染问题,有害废弃物越境迁移 | |
| D. | 全球增温问题,臭氧空洞问题,酸雨问题 |
20.用锌锰电池电解足量的饱和食盐水(电极为惰性电极),若产生的气体共0.05mol,则理论上电池消耗锌的物质的量最少为( )
| A. | 0.025mol | B. | 0.05mol | C. | 0.075mol | D. | 0.10mol |
17.NA代表阿伏伽德罗常数,下列叙述正确的是( )
| A. | 1mol铵根离子与[H3O]+构型相同 | |
| B. | 25℃时,pH=13的NaOH溶液中OH-的数目0.1NA | |
| C. | 常温常压下,92g NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 甲烷与Cl2光照下反应,主要生成2,4-二氯甲苯 |
4.下列说法中正确的是( )
| A. | CH4、C2H2、HCN都是含有极性键的非极性分子 | |
| B. | CO2与SO2的空间构型相似,都是非极性分子 | |
| C. | HC≡C一CH(CH3)-CH=CH一CH3分子中含有1个手性碳原子 | |
| D. | 无机含氧酸分子中有几个氢原子,它就属于几元酸 |
4.在新制的饱和氯水中,若改变某一条件,下列叙述正确的是( )
| A. | 再通入少量氯气,$\frac{c(O{H}^{-})}{c(HClO)}$减小 | |
| B. | 光照过程中,有气泡冒出,溶液的导电性减弱 | |
| C. | 加入少量的NaHSO3固体,pH增大,溶液漂白性增强 | |
| D. | 加入少量的NaHCO3固体,pH增大,溶液漂白性增强 |
11.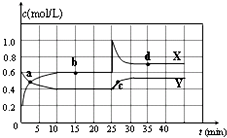 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入 一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入 一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入 一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入 一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )| A. | 图中的两条曲线,X是表示NO2浓度随时间的变化曲线 | |
| B. | 前10 min内用v(N2O4)表示的化学反应速率为0.2 mol/(L•min) | |
| C. | 25 min时,NO2转变为N2O4的反应速率增大,不可能是将密闭容器的体积缩小为1L引起的 | |
| D. | 前10 min内用v(NO2)表示的化学反应速率为0.04 mol/(L•min) |
8.下列表达方式错误的是( )
| A. |  | B. |  | C. | ${\;}_{8}^{18}$O | D. |  |
9.某高分子缓释药物的结构简式见如图: 下列说法不正确的是( )
下列说法不正确的是( )
 下列说法不正确的是( )
下列说法不正确的是( )| A. | 该药物在人体胃液中能发生水解反应 | |
| B. | 其水解产物中可能有乙二醇 | |
| C. | 其水解产物中可能有芳香族化合物 | |
| D. | 该高分子化合物通过缩聚反应得到 |