题目内容
20.用锌锰电池电解足量的饱和食盐水(电极为惰性电极),若产生的气体共0.05mol,则理论上电池消耗锌的物质的量最少为( )| A. | 0.025mol | B. | 0.05mol | C. | 0.075mol | D. | 0.10mol |
分析 用惰性电极电解饱和食盐水,阳极上生成Cl2、阴极上生成H2,因为转移电子相等,所以阴阳极上析出气体物质的量相等,所以每个电极上生成气体物质的量为0.05mol×$\frac{1}{2}$=0.025mol,转移电子物质的量=0.025mol×2=0.05mol,串联电路中转移电子相等,据此计算消耗锌的物质的量.
解答 解:用惰性电极电解饱和食盐水,阳极上生成Cl2、阴极上生成H2,因为转移电子相等,所以阴阳极上析出气体物质的量相等,所以每个电极上生成气体物质的量为0.05mol×$\frac{1}{2}$=0.025mol,转移电子物质的量=0.025mol×2=0.05mol,串联电路中转移电子相等,则消耗n(Zn)=$\frac{0.05mol}{2}$=0.025mol,故选A.
点评 本题以电解原理为载体考查物质的量有关计算,为高频考点,明确各个电极上析出物质及串联电路转移电子特点是解本题关键,注意守恒法的应用,题目难度不大.

练习册系列答案
相关题目
10.下列与金属腐蚀有关的说法,正确的是( )
| A. | 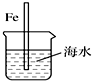 图中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. |  图中,发生吸氧腐蚀 | |
| C. | 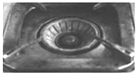 图中,燃烧灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 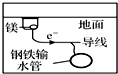 图中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁相当于原电池的正极 |
11.下列离子方程式中,不正确的是( )
| A. | 向FeCl2溶液中通入Cl22Fe2++Cl2═2Fe3++2Clˉ | |
| B. | FeCl3溶液跟过量氨水 Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+ | |
| C. | 碳酸氢钙溶液跟稀硝酸 Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| D. | 钠与水的反应 2Na+2H2O═2Na++2OH-+H2↑ |
8.下列关于钠及其化合物的说法不正确的是( )
| A. | 钠与水反应放出氢气 | B. | 钠与水反应放出氧气 | ||
| C. | 实验室中钠常保存在煤油中 | D. | Na2O2 与水反应放出氧气 |
15.下列反应的离子方程式中,书写正确的是( )
| A. | 钠跟水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 铁粉跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液跟稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙跟盐酸反应:CO32-+2H+═H2O+CO2↑ |
5.下列物质中,只能与NaOH溶液作用,不能与盐酸作用的是( )
| A. | KHSO4 | B. | (NH4)2CO3 | C. | NaHCO3 | D. | NH4HCO3 |
12.下列关于C2H4和C3H6两种气体,下列说法正确的是( )
| A. | 质量相同时,分子数相同 | B. | 同温同压下,密度相同 | ||
| C. | 体积相同时,分子数相同 | D. | 质量相等时,原子数相同 |
9.在沸腾炉中进行反应时,被氧化的元素是( )
| A. | 只有硫 | B. | 只有铁 | C. | 硫和铁 | D. | 硫和氧 |
20.A-H及X均为中学化学常见物质,X是一种金属单质,A、B是非金属单质且A在常温下为气体.甲是短周期元素形成的盐,且是某种消毒液的有效成分.它们在一定条件下有如下转化关系(图中条件均已略去).
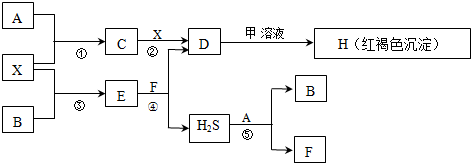
试回答下列问题:
(1)鉴定D中阳离子(不考虑H+)的操作和现象是向少量D溶液中滴入几滴KSCN溶液,无现象,再加入H2O2溶液,溶液显红色.说明D中有Fe2+离子
(2)A与B在一定条件下反应生成一种原子个数比为1:1的分子Y,Y分子中各原子皆达8电子结构,则Y的电子式为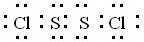 .
.
(3)甲能使D迅速转化为H,甲是NaClO(写化学式),此时甲溶液表现的性质是
氧化性和碱性.将甲溶液与溶液C混合,也能迅速生成H,写出反应的离子方程式Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO.
(4)反应⑤的化学方程式为H2S+Cl2=S↓+2HCl.
(5)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液部分pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1 Mn2+、0.10mol•L-1 H2S,当溶液pH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13].

试回答下列问题:
(1)鉴定D中阳离子(不考虑H+)的操作和现象是向少量D溶液中滴入几滴KSCN溶液,无现象,再加入H2O2溶液,溶液显红色.说明D中有Fe2+离子
(2)A与B在一定条件下反应生成一种原子个数比为1:1的分子Y,Y分子中各原子皆达8电子结构,则Y的电子式为
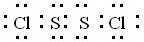 .
.(3)甲能使D迅速转化为H,甲是NaClO(写化学式),此时甲溶液表现的性质是
氧化性和碱性.将甲溶液与溶液C混合,也能迅速生成H,写出反应的离子方程式Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO.
(4)反应⑤的化学方程式为H2S+Cl2=S↓+2HCl.
(5)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液部分pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发).
| pH | 1 | 3 | 5 | 7 | 9 | 11 | 13 |
| c(S2-) | 1.4×10-19 | 1.4×10-15 | 1.4×10-11 | 6.7×10-7 | 1.9×10-5 | 1.3×10-3 | 5.7×10-2 |
②某溶液含0.020mol•L-1 Mn2+、0.10mol•L-1 H2S,当溶液pH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13].