题目内容
4.下列说法中正确的是( )| A. | CH4、C2H2、HCN都是含有极性键的非极性分子 | |
| B. | CO2与SO2的空间构型相似,都是非极性分子 | |
| C. | HC≡C一CH(CH3)-CH=CH一CH3分子中含有1个手性碳原子 | |
| D. | 无机含氧酸分子中有几个氢原子,它就属于几元酸 |
分析 A.HCN的结构不对称,为极性分子;
B.二氧化碳为直线型、非极性分子,而二氧化硫为V型、极性分子;
C.碳原子上连接四个不同的原子或原子团的为手性碳原子;
D.据酸电离出的氢离子数目可以将酸分为一元酸、二元酸、多元酸,含氧酸中H原子个数与酸的元数不一定相等.
解答 解:A.CH4、C2H2为极性键构成的非极性分子,而HCN为极性分子,故A错误;
B.SO2分子为V形结构,分子中正负电荷重心不重合,属于极性分子,CO2分子为直线型对称结构,分子中正负电荷重心重合,属于非极性分子,故B错误;
C.HC≡C一CH(CH3)-CH=CH一CH3分子中左边第3个C原子连接了四个不同的原子或原子团,为手性碳原子,故C正确;
D.无机含氧酸中H原子个数与酸的元数不一定相等,如H3PO3为一元酸,故D错误;
故选C.
点评 本题考查较为综合,涉及分子极性与共价键极性判断、分子构型判断、手性碳原子等知识,题目难度中等,注意掌握极性键与非极性键、极性分子与非极性分子的概念,明确手性碳原子的特点及酸的分类依据,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
14.向0.1mol•L-1的H2SO4溶液中滴入0.1mol•L-1过量的Ba(OH)2溶液,溶液的导电能力发生变化,其电流强度(I)随加入Ba(OH)2溶液的体积(V)的变化曲线正确的是( )
| A. | 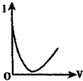 | B. | 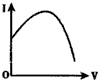 | C. | 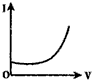 | D. |  |
15.下列反应的离子方程式中,书写正确的是( )
| A. | 钠跟水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 铁粉跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液跟稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙跟盐酸反应:CO32-+2H+═H2O+CO2↑ |
12.下列关于C2H4和C3H6两种气体,下列说法正确的是( )
| A. | 质量相同时,分子数相同 | B. | 同温同压下,密度相同 | ||
| C. | 体积相同时,分子数相同 | D. | 质量相等时,原子数相同 |
9.在沸腾炉中进行反应时,被氧化的元素是( )
| A. | 只有硫 | B. | 只有铁 | C. | 硫和铁 | D. | 硫和氧 |
3.将0.5mol SO2和0.2mol O2置于密闭容器中发生反应:2SO2+O2$?_{催化剂}^{高温}$ 2SO3.下列关于该反应的说法正确的是( )
| A. | 最终可生成0.4 mol SO3 | |
| B. | 当v正(O2)=v逆(SO2)=0时一定达化学平衡 | |
| C. | 升高温度反应速率减小 | |
| D. | 缩小体积增大压强反应速率增大 |
4.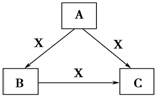 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )| A. | 若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2 | |
| B. | 若X为KOH溶液,则A可为AlCl3 | |
| C. | 若X为O2,则A可为硫化氢 | |
| D. | 若X为Cl2,则C可为FeCl3 |
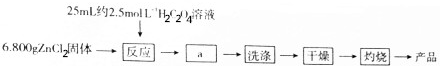
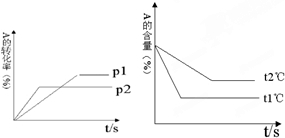 回答下列问题
回答下列问题