题目内容
9.实验室可利用反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O制取氯气,请结合反应回答以下问题:(1)用“单线桥法”表示反应中电子转移的方向和数目:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2+8H2O
(2)该反应中,氧化剂是KMnO4 ,氧化产物是Cl2,被氧化与未被氧化的HCl的物质的量之比为5:3,若有7.3g HCl被氧化,则产生Cl2的质量为7.1g,转移的电子数为0.2NA或1.204×1023.
分析 在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素的化合价降低,Cl元素的化合价升高,根据化合价的变化判断转移的电子数,反应中16molHCl参加反应,其中10mol被氧化,另外6mol作为酸与金属离子结合,以此来解答.
解答 解:(1)反应中2molKMnO4得到10mol电子,HCl失去10mol电子,则单线桥法标出电子转移的方向和数目为: ,故答案为:
,故答案为: ;
;
(2)在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O的反应中,Mn元素化合价降低,所以KMnO4 是氧化剂,
HCl中Cl元素化合价升高,反应物HCl是还原剂,具有还原性,Cl元素被氧化,对应产物Cl2是氧化产物,反应中16molHCl参加反应,其中10mol被氧化,另外6mol作为酸与金属离子结合,则被氧化与未被氧化的HCl的质量之比比为5:3;
若有7.3g HCl被氧化,2HCl~Cl2,则生成Cl2为7.1g,转移电子数目为:0.2NA或1.204×1023;故答案为:KMnO4; Cl2;7.1g;0.2NA或1.204×1023.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应概念的判断的考查,注意从化合价角度分析,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列化学用语正确的是( )
| A. | HCO3-+H2O═CO32-+H3O+ | B. | NaCl(S)═Na+(aq)+Cl-(aq) | ||
| C. | S2-+H2O?H2S+2OH- | D. | SiO32-+H2O?H2SiO3+2OH- |
17.化学兴趣小组对牙膏中摩擦剂成分及其含量进行探究.查资料得知:某品牌牙膏中的摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分不与酸、碱反应.
I.利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.
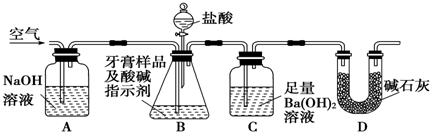
依据实验过程回答下列问题:
(1)以下检查整套装置气密性的操作正确的是a(填字母代号).
a.组装好仪器后,密封装置A的进气口和装置D的出气口,分液漏斗中装水,打开分液漏斗的两个活塞,若水滴不进去,则整套装置不漏气
b.裝好药品后,密封装置A的进气口和装置D的出气口,打开分液漏斗的两个活塞,若盐酸滴不进去,则整套装置不漏气
c.微热B,若A中溶液进入长导管,C中长导管冒气泡,则整套装置不漏气
(2)实验过程中需持续缓缓通入空气.其作用除了可搅拌B、C中的反应物外,还有把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收.
(3)盐酸有一定程度的挥发性,为什么该兴趣小组不在B、C之间增添盛有饱和碳酸氢钠溶液的洗气装置?碳酸氢钠虽能吸收盐酸,但也产生CO2,HCl即使进入装置C中,由于Ba(OH)2是足量的,就会被Ba(OH)2中和,不会溶解BaCO3.
(4)实验中准确称取16.00g样品三份,进行三次测定,测得BaCO3平均质量为7.88g.则样品中碳酸钙的质量分数为25%.
Ⅱ.为确定该牙膏摩擦剂中氢氧化铝的存在,请设计实验.
I.利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.

依据实验过程回答下列问题:
(1)以下检查整套装置气密性的操作正确的是a(填字母代号).
a.组装好仪器后,密封装置A的进气口和装置D的出气口,分液漏斗中装水,打开分液漏斗的两个活塞,若水滴不进去,则整套装置不漏气
b.裝好药品后,密封装置A的进气口和装置D的出气口,打开分液漏斗的两个活塞,若盐酸滴不进去,则整套装置不漏气
c.微热B,若A中溶液进入长导管,C中长导管冒气泡,则整套装置不漏气
(2)实验过程中需持续缓缓通入空气.其作用除了可搅拌B、C中的反应物外,还有把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收.
(3)盐酸有一定程度的挥发性,为什么该兴趣小组不在B、C之间增添盛有饱和碳酸氢钠溶液的洗气装置?碳酸氢钠虽能吸收盐酸,但也产生CO2,HCl即使进入装置C中,由于Ba(OH)2是足量的,就会被Ba(OH)2中和,不会溶解BaCO3.
(4)实验中准确称取16.00g样品三份,进行三次测定,测得BaCO3平均质量为7.88g.则样品中碳酸钙的质量分数为25%.
Ⅱ.为确定该牙膏摩擦剂中氢氧化铝的存在,请设计实验.
| 实验步骤 | 预期现象与结论 |
| 取适量牙膏样品于试管中,加入足量的NaOH溶液,过滤, 向滤液中滴加盐酸. | 滤液中先出现白色沉淀, 随后沉淀溶解,说明该牙膏摩擦剂中含氢氧化铝. |
4.下列说法正确的是( )
| A. | 固体NaCl不导电,所以NaCl是非电解质 | |
| B. | 蔗糖、酒精在水溶液和熔融状态时均不导电,所以它们是非电解质 | |
| C. | 铜、石墨均导电,所以它们是电解质 | |
| D. | CO2的水溶液能导电,所以CO2是电解质 |
14.下列表示正确的是( )
| A. | CH4的球棍模型示意图为 | B. | H2O2的电子式: | ||
| C. | 葡萄糖的最简式为CH2O | D. | 聚丙烯的结构简式: |
1.钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能.如图是化工生产中制备金属钼的主要流程图,已知钼酸难溶于水.
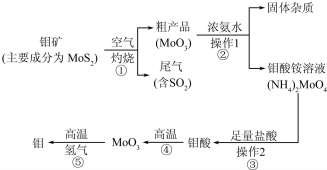
(1)写出反应①的化学方程式:2MoS2+7O2$\frac{\underline{\;高温\;}}{\;}$2MoO3+4SO2 .
(2)写出反应②的化学方程式:MoO3+2NH3•H2O=(NH4)2MoO4.
(3)反应①的尾气可以用碳酸钠溶液吸收.已知
根据表中提供的数据可知,在溶液中不能大量共存的微粒是
A.HCO3-、HSO3- B HCO3-、SO32-
C.HCO3-、H2SO3 D HSO3-、CO32-
向过量碳酸钠溶液中通人少量二氧化硫,写出反应的离子方程式:2CO32-+SO2+H2O=SO32-+2HCO3-.
(4)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有烧杯、漏斗、玻璃棒.
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4$\frac{\underline{\;高温\;}}{\;}$2CO+2H2,CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2.含甲烷体积分数为80%的10L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为41.1g(小数点后保留1位,钼的相对原子质量为96).

(1)写出反应①的化学方程式:2MoS2+7O2$\frac{\underline{\;高温\;}}{\;}$2MoO3+4SO2 .
(2)写出反应②的化学方程式:MoO3+2NH3•H2O=(NH4)2MoO4.
(3)反应①的尾气可以用碳酸钠溶液吸收.已知
| 化学式 | 电离常数 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
A.HCO3-、HSO3- B HCO3-、SO32-
C.HCO3-、H2SO3 D HSO3-、CO32-
向过量碳酸钠溶液中通人少量二氧化硫,写出反应的离子方程式:2CO32-+SO2+H2O=SO32-+2HCO3-.
(4)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有烧杯、漏斗、玻璃棒.
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4$\frac{\underline{\;高温\;}}{\;}$2CO+2H2,CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2.含甲烷体积分数为80%的10L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为41.1g(小数点后保留1位,钼的相对原子质量为96).
 ,E
,E ;
; ;
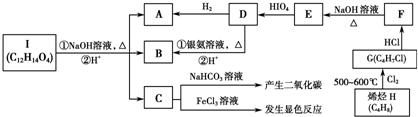
; A、B、C、D、E为原子序数依次增大的短周期元素,B、C相邻且同周期,C原子中含有8种运动状态不同的电子.A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂.D是地壳中含量最多的金属元素.E元素为同周期电负性最大的元素.E和D可形成化合物丙.F为第四周期未成对电子数最多的元素
A、B、C、D、E为原子序数依次增大的短周期元素,B、C相邻且同周期,C原子中含有8种运动状态不同的电子.A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂.D是地壳中含量最多的金属元素.E元素为同周期电负性最大的元素.E和D可形成化合物丙.F为第四周期未成对电子数最多的元素