题目内容
14. 常温下,向20mL0.1mol•L-1氨水中滴加某浓度的硫酸溶液,溶液中水电离的氢离子浓度随加入硫酸的体积变化如图.下列说法错误的是( )
常温下,向20mL0.1mol•L-1氨水中滴加某浓度的硫酸溶液,溶液中水电离的氢离子浓度随加入硫酸的体积变化如图.下列说法错误的是( )| A. | 若a等于1.0×10-11 mol•L-1,则此时氨水的电离度为1% | |
| B. | c点时氨水与硫酸恰好完全反应 | |
| C. | c点所示溶液中:c(H+)-c(OH-)═c(NH3•H2O) | |
| D. | 若b、d对应的水电离的氢离子浓度为1.0×10-7 mol•L-1,此时两溶液中都存在:c(NH4+)═2c(SO42-) |
分析 A.水电离的氢离子浓度为1.0×10-11 mol•L-1,根据Kw求出溶液中的氢氧根离子的浓度,再求出氨水的电离度;
B.c点水的电离程度最大,说明恰好生成硫酸铵;
C.根据质子守恒判断;
D.c点硫酸与氨水恰好反应,则b点硫酸不足,d点硫酸过量.
解答 解:A.水电离的氢离子浓度为1.0×10-11 mol•L-1,由Kw可知溶液中的氢氧根离子的浓度为1.0×10-3 mol•L-1,则出氨水的电离度为$\frac{1{0}^{-3}}{0.1}$×100%=1%,故A正确;
B.c点水的电离程度最大,说明恰好生成硫酸铵,即c点时氨水与硫酸恰好完全反应,故B正确;
C.c点溶液中溶质为硫酸铵,溶液中质子守恒为c(H+)═c(NH3•H2O)+c(OH-),则c(H+)-c(OH-)═c(NH3•H2O),故C正确;
D.c点硫酸与氨水恰好反应,则b点硫酸不足,d点硫酸过量,溶液中氢离子浓度大于1.0×10-7 mol•L-1,d点时:c(NH4+)≠2c(SO42-),故D错误.
故选D.
点评 本题考查酸碱混合溶液定性判断,题目难度中等,侧重考查学生分析判断及计算能力,明确图中曲线上各点溶质成分及其性质、电离平衡常数与盐类水解平衡常数关系是解本题关键.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
5.实验室除去硝基苯中的氮氧化物杂质时用不到的仪器是( )
| A. | 漏斗 | B. | 分液漏斗 | C. | 烧杯 | D. | 铁架台 |
2.下列图象与选项对应的是( )
| A. |  AlCl3(aq)中滴入NaOH(aq) | B. |  Al(OH)3中滴入NaNO3(aq) | ||
| C. |  AlCl3(aq)中滴入氨水 | D. |  Al(OH)3中通入CO2 |
9.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2L甲醇中含有的分子数为0.5NA | |
| B. | 4.4gN2O和CO2的混合气体中含有的原子数为0.3NA | |
| C. | 4.2g乙烯和丙烯混合气体中含有的共价键数为0.6NA | |
| D. | 25°C时,1.0L,PH=13 的 Ba(OH)2 溶液中含有的OH-数为0.2NA |
6.根据所给的信息和标志,判断下列说法不正确的是( )
| A | B | C | D |
 《神农本草经》记载,麻黄能“止咳逆上气” |  84消毒液主要成分是NaClO |  易拉罐主要成分是金属铝 |  贴有该标志的物品是可回收物 |
| 古代中国人已用麻黄治疗咳嗽 | 用于杀菌消毒和衣物的洗涤漂白 | 不可以用氢氧化钠溶液将其溶解 | 废纸、塑料、玻璃、金属均可回收 |
| A. | A | B. | B | C. | C | D. | D |
3.固体酒精因储存和运输方便而被广泛使用.其制备方法之一如图:下列说法不正确的是( )
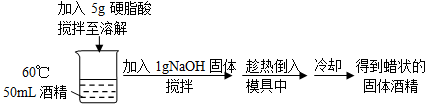

| A. | 将酒精加热到60℃的目的是使更多的硬脂酸溶解在其中 | |
| B. | 上述过程中,有酸碱中和反应发生 | |
| C. | 上述过程中,加入NaOH发生皂化反应 | |
| D. | 常温下,硬脂酸钠在酒精中的溶解度小于在水中的溶解度 |
9.下列叙述中正确的是( )
| A. | 3,3-二甲基-1-丁烯催化加氢后得到3,3-二甲基-丁烷 | |
| B. | 2-甲基-1,3-丁二烯与Br2的加成产物有3种 | |
| C. | 根据所有原子不在同一平面上可以说明C4H6的某烃是1-丁炔而不是CH2=CH-CH=CH2 | |
| D. | 已知具有单双键交替长链(如:-CH=CH-CH=CH-CH=CH-)的高分子有可能成为导电塑料,故聚乙烯和聚乙炔均可成为导电塑料 |



