题目内容
9.下列各组中两种物质作用时,反应条件或反应物用量改变,对生成物没有影响的是( )| A. | Fe与稀HNO3 | B. | Na2O2与CO2 | ||
| C. | NaOH溶液与CO2 | D. | AlCl3溶液与NaOH溶液 |
分析 A.与Fe的量有关;
B.二者反应生成碳酸钠和氧气;
C.与反应物的量有关;
D.与反应物的量有关.
解答 解:A.Fe少量时与硝酸反应生成硝酸铁,Fe过量时生成硝酸亚铁,故A不选;
B.二者反应与反应物的用量、反应条件无关,故B选;
C.NaOH足量时反应生成碳酸钠,NaOH不足时反应生成碳酸氢钠,故C不选;
D.NaOH不足时生成氢氧化铝,NaOH足量时生成偏铝酸钠,故D不选;
故选B.
点评 本题考查金属的性质及反应,为高频考点,把握物质的性质、发生的反应等为解答的关键,侧重分析与应用能力的考查,注意与量有关的反应,题目难度不大.

练习册系列答案
相关题目
20.用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏低的原因可能是( )
| A. | 滴定终点读数时,仰视滴定管的刻度,其它操作均正确 | |
| B. | 盛装未知液的滴定管用蒸馏水洗过,未用待测液润洗 | |
| C. | 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 | |
| D. | 未用标准液润洗碱式滴定管 |
17.部分弱电解质的电离平衡常数如下表,下列说法不正确的是( )
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 25℃时,若将pH=3的盐酸与pH=11的氨水混合后溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水) | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 结合H+的能力:CO32->HCO3->CN->HCOO- | |
| D. | 0.1mol/L的NaHCO3溶液中:c(H2CO3)+c(H+)=c(OH-)+c(CO32-) |
4.下列物质之间的相互关系不正确的是( )
| A. | CH3-CH2-NO2和H2N-CH2-COOH互为同分异构体 | |
| B. | O2和O3互为同素异形体 | |
| C. | H、D、T互为同位素 | |
| D. | 干冰和冰为同一种物质 |
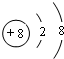 .
. 和XY2
和XY2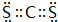 .
.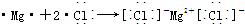 .
. .
.