题目内容
10.下列各项比较错误的是( )| A. | 微粒半径:r(Na+)>r(Mg2+)>r(Al3+) | B. | 酸性强弱:HClO4>H2SO4>H3PO4 | ||
| C. | 稳定性:HF>H2O>H2S | D. | 碱性强弱:Ge(OH)4>Sn(OH)4>Pb(OH)4 |
分析 A.具有相同核外电子排布的离子,质子数越大,半径越小;
B.非金属性越强,最高价氧化物对应水化物的酸性越强;
C.非金属性越强,气态氢化物越稳定;
D.金属性越强,最高价氧化物对应水化物的碱性越强.
解答 解:A.Na+、Mg2+、Al3+核外电子排布形同,质子数越大,半径越小,因此微粒半径:r(Na+)>r(Mg2+)>r(Al3+),故A正确;
B.非金属性Cl>S>P,最高价氧化物对应水化物的酸性HClO4>H2SO4>H3PO4,故B正确;
C.非金属性F>O>S,气态氢化物越稳定性HF>H2O>H2S,故C正确;
D.金属性Ge<Sn<Pb,最高价氧化物对应水化物的碱性强弱:Ge(OH)4<Sn(OH)4<Pb(OH)4,故D错误;
故选D.
点评 本题考查元素的性质的递变规律,题目难度不大,注意元素周期律以及元素的性质与元素对应单质、化合物性质的关系.

练习册系列答案
 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
20.下列说法中正确的一组是( )
| A. | H2和D2互为同位素 | B. |  和 和 互为同分异构体 互为同分异构体 | ||
| C. | 正丁烷和异丁烷是互为同分异构体 | D. | 四氯化碳的电子式 |
1.进行化学实验必须注意安全,下列说法正确的是( )
| A. | 酒精在实验台上燃烧时,用水扑灭火焰 | |
| B. | 给试管中的液体加热时,试管口不能对着别人 | |
| C. | 在烧杯中稀释浓硫酸时,应将水慢慢注入浓硫酸中,并用玻璃棒搅拌 | |
| D. | 不慎将浓硫酸沾到皮肤上,应用较多的水冲洗,然后涂上硼酸溶液 |
18.下列化合物的核磁共振氢谱中出现峰个数最多的是( )
| A. | 2,2,3,3-四甲基丁烷 | B. | 2,3,3,4-四甲基戊烷 | ||
| C. | 3,4-二甲基己烷 | D. | 2,5-二甲基己烷 |
5.若向某溶液中加入适量的溴水,溶液仍呈无色,则该溶液中可能含有的离子是( )
| A. | Cu2+ | B. | I- | C. | SO32- | D. | Fe2+ |
15.下列化合物中含有手性碳原子的是( )
| A. | CCl2F2 | B. |  | C. | CH3CH2OH | D. |  |
2.在120℃、101kPa时,将1L丁烷和若干升O2混合,点燃使之充分反应.反应后,恢复到原温度和原压强,测得的气体体积为mL,若通过足量碱石灰,气体体积变为nL.若m-n=8,则反应消耗掉的O2体积是(同温同压)( )
| A. | 5L | B. | 5.5L | C. | 6L | D. | 6.5L |
20.用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏低的原因可能是( )
| A. | 滴定终点读数时,仰视滴定管的刻度,其它操作均正确 | |
| B. | 盛装未知液的滴定管用蒸馏水洗过,未用待测液润洗 | |
| C. | 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 | |
| D. | 未用标准液润洗碱式滴定管 |
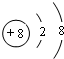 .
. 和XY2
和XY2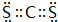 .
.