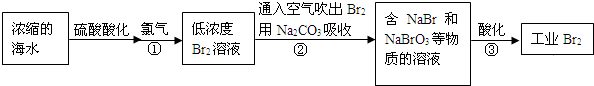
题目内容
下列有关物质性质的应用正确的是( )
| A、常温下干燥氯气与铁不反应,可以用钢瓶储存氯水 |
| B、铜的金属活泼性比铁的弱,可在铁船闸上装若干铜块以减缓其腐蚀 |
| C、二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 |
| D、次氯酸钠具有强氧化性,可用于配制消毒液 |
考点:氯气的化学性质,氯、溴、碘及其化合物的综合应用,二氧化硫的化学性质,铜金属及其重要化合物的主要性质
专题:元素及其化合物
分析:A.氯水是氯气的水溶液,液氯是氯气的液态形式;
B.铜的金属活泼性比铁的弱,在海水中形成原电池,铁做负极先被氧化;
C.二氧化硫有毒,不能用于食品添加剂;
D.次氯酸钠中氯元素处于+1价,具有强氧化性.
B.铜的金属活泼性比铁的弱,在海水中形成原电池,铁做负极先被氧化;
C.二氧化硫有毒,不能用于食品添加剂;
D.次氯酸钠中氯元素处于+1价,具有强氧化性.
解答:
解:A.氯气溶与水得到的溶液叫氯水,氯气和水反应生成盐酸和次氯酸,与铁反应,腐蚀铁,故A错误;
B.铁船闸上装若干铜块,形成原电池,铁做负极,加速铁的腐蚀,故B错误;
C.二氧化硫有毒,不能用于食品添加剂,故C错误;
D.次氯酸钠具有强氧化性,可用于配制消毒液,故D正确;
故选:D.
B.铁船闸上装若干铜块,形成原电池,铁做负极,加速铁的腐蚀,故B错误;
C.二氧化硫有毒,不能用于食品添加剂,故C错误;
D.次氯酸钠具有强氧化性,可用于配制消毒液,故D正确;
故选:D.
点评:本题考查了氯气、二氧化硫、次氯酸钠的性质,金属的防护方法--牺牲阳极的阴极保护,题目难度不大,注意液氯和氯水的区别.

练习册系列答案
相关题目
某小分子抗癌药物的分子结构如图所示,下列说法正确的是( )
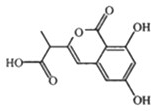

| A、1mol该有机物最多可以和5mol NaOH反应 |
| B、1mol该有机物与浓溴水反应,最多消耗3mol Br2 |
| C、该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色 |
| D、该有机物容易发生加成、取代、中和、消去等反应 |
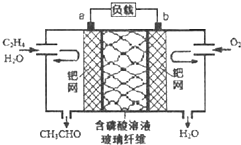 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A、该电池为可充电电池 |
| B、每有0.1mol O2反应,则迁移H+0.4mol |
| C、正极反应式为:CH2=CH2-2e-+2OH-═CH3CHO+H2O |
| D、电子移动方向:电极a→磷酸溶液→电极b |
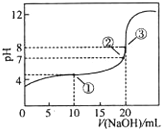 在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol?L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,正确的是( )
在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol?L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,正确的是( )| A、该中和滴定过程,最宜用石蕊作指示剂 |
| B、图中点②所示溶液中,c(CH3COO-)=c(Na+) |
| C、图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 |
| D、滴定过程中的某点,会有c(Na+)>c(CH3COO-)>c(H+)>c(OH-)的关系存在 |
以下情况都有气体产生,其中不产生红棕色气体的是( )
| A、加热浓硝酸 |
| B、光照硝酸银 |
| C、加热硝酸钙 |
| D、加热溴化钾和浓硫酸混合物 |
 英国赫瑞瓦特大学陶善文博士研究出以尿素为动力的燃料电池新技术.用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,关于该电池描述正确的是( )
英国赫瑞瓦特大学陶善文博士研究出以尿素为动力的燃料电池新技术.用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,关于该电池描述正确的是( )| A、电池工作时H+移向负极 |
| B、该装置还可以将电能转化成为化学能 |
| C、理论上电池工作时,每消耗67.2L O2时,可以净化2mol CO(NH2)2 |
| D、电池的负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+ |
 将CO2在一定条件下与H2反应转化为甲醇(CH4O)是变废为宝的好方法,一定条件下,每转化1kg CO2放出的热量为1113.64KJ,CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体),下列叙述中正确的是( )
将CO2在一定条件下与H2反应转化为甲醇(CH4O)是变废为宝的好方法,一定条件下,每转化1kg CO2放出的热量为1113.64KJ,CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体),下列叙述中正确的是( )| A、在进行到3分钟时,CO2和H2所表达的反应速率值相等,均为0.5mol?L-1?min-1 | ||
| B、此反应的热化学方程式为:CO2(g)+3H2(g)?CH4O(g)+H2O(g)△H=-49.0KJ/mol | ||
C、此条件下反应的平衡常数为
| ||
| D、降低温度,此反应的平衡常数可能为0.8 |