题目内容
3.在元素周期表中,原子最外电子层只有2个电子的元素是( )| A. | 无法判断是哪一类元素 | B. | 一定是稀有气体元素 | ||
| C. | 一定是过渡元素 | D. | 一定是金属元素 |
分析 在元素周期表中,最外层电子只有2个电子的有He、第IIA族元素、部分过渡元素,据此分析.
解答 解:在元素周期表中,最外层电子只有2个电子的有He、第IIA族元素、部分过渡元素,
A.根据以上分析,无法判断是哪一类元素,故A正确;
B.该元素可能是金属元素,如Mg,故B错误;
C.该元素可能是主族元素,如Ba,故C错误;
D.该元素可能是非金属元素,如He,故D错误;
故选A.
点评 本题考查了元素的判断,明确元素核外电子排布是解本题关键,难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
14.铁丝与水蒸气反应的产物有( )
| A. | O2 | B. | Fe3O4 | C. | Fe2O3 | D. | FeO |
11.常温下,下列各组离子或分子在指定溶液中能大量共存的是( )
| A. | 甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO${\;}_{4}^{2-}$ | |
| B. | c(NaHCO3)=0.1 mol•L-1的溶液中:K+、C6H5O-、SO${\;}_{4}^{2-}$、CO32- | |
| C. | 含有大量Fe2+的溶液:Na+、SO42+、NH4+、Fe(CN)63? | |
| D. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、S2? |
18.某兴趣小组设计了如图所示装置(部分夹持装置已略去)进行实验探究.
【实验一】探究影响化学反应速率的因素.
圆底烧瓶中装锌片(两次实验中所用锌片大小和外形相同)、恒压分液漏斗中装稀硫酸,以生成20.0mL气体为计时终点,结果为t1>t2.
检查该装置气密性的方法是从量气管右侧管口加水至左右两管出现液面高度差时停止加水,若较长时间能保持液面高度差不变,则说明装置气密性好.
比较实验I和Ⅱ可以得出的结论是在其它条件一定时,化学反应速率随反应物浓度的增大而增大.
【实验二】探究铁的电化学腐蚀.

①圆底烧瓶中装铁粉和碳粉混合物,恒压分液漏斗中装稀硫酸,打开活塞加入稀硫酸后量气管中出现的现象是:左侧液面下降右侧液面上升(选填“上升”、“下降”).
②圆底烧瓶中装与①相同量的铁粉和碳粉混合物,恒压分液漏斗中装食盐水,打开活塞加入食盐水后,你预测量气管中出现的现象是:吸氧腐蚀消耗氧气,反应放热使气体温度升高,容器内压强恰好不变,液面没有升降.实际观察到的现象可能与预测并不一致,装置气密性良好,原因是发生吸氧腐蚀消耗氧气,气体分子数减小.
【实验一】探究影响化学反应速率的因素.
圆底烧瓶中装锌片(两次实验中所用锌片大小和外形相同)、恒压分液漏斗中装稀硫酸,以生成20.0mL气体为计时终点,结果为t1>t2.
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol•L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 3 | t2 |
比较实验I和Ⅱ可以得出的结论是在其它条件一定时,化学反应速率随反应物浓度的增大而增大.
【实验二】探究铁的电化学腐蚀.

①圆底烧瓶中装铁粉和碳粉混合物,恒压分液漏斗中装稀硫酸,打开活塞加入稀硫酸后量气管中出现的现象是:左侧液面下降右侧液面上升(选填“上升”、“下降”).
②圆底烧瓶中装与①相同量的铁粉和碳粉混合物,恒压分液漏斗中装食盐水,打开活塞加入食盐水后,你预测量气管中出现的现象是:吸氧腐蚀消耗氧气,反应放热使气体温度升高,容器内压强恰好不变,液面没有升降.实际观察到的现象可能与预测并不一致,装置气密性良好,原因是发生吸氧腐蚀消耗氧气,气体分子数减小.
15.下列离子反应书写不正确的是( )
| A. | CuSO4溶液与过量浓氨水反应的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+ | |
| B. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| D. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
12.下图是应用电化学方法检测空气中SO2的原理示意图,下列有关说法不正确的是( )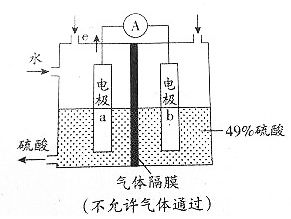

| A. | 该装置工作时能将化学能转化为电能,并有H2SO4生成 | |
| B. | 电极b表面O2发生还原反应,电极b附近溶液的pH升高 | |
| C. | 气体样品从电极a区域通入,样品中的SO2在电极a表面得到电子 | |
| D. | 电极a表面发生的电极反应时为SO2+2H2O-2e-=${SO}_{4}^{2-}$+4H+ |
5.某同学为了测定三聚氰胺的分子式和结构简式.设计了如下实验.他查阅资料得知:三聚氰胺的相对分子质量为126,三聚氰胺在常温下为晶体,在加热条件下能与氧气发生反应生成二氧化碳、氮气和水.现有12.6g三聚氰胺晶体按图所示实验装置反应(假设三聚氰胺完全转化成产物).
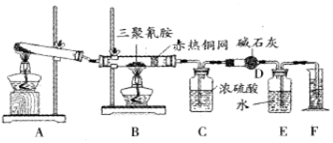
(1)写出A装置中发生反应的化学方程式:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑或2KMnO4$\frac{\underline{\;△\;}}{\;}$K2MnO4+MnO2+O2↑;
(2)C装置能不能与D装置互换?不能,(填“能”或“不能”),理由是浓硫酸吸水,碱石灰吸收二氧化碳,若互换位置,则碱石灰会同时吸收水和二氧化碳,导致实验失败
(3)当B装置中反应完全发生后,读取F中水的体积,实验操作顺序为②③①(填序号).
①读数 ②冷却至室温 ③调平E、F装置中液面
(4)测定数据如表:
经测定,收集到的气体折合成标准状况下的体积为6.72L.
①利用上述实验数据,通过计算可知三聚氰胺的实验式为CN2H2.
②三聚氰胺的分子式为C3N6H6.
③若装置中没有铜网,则对测定结果的影响是测定所得分子式的氮原子数偏大,而碳、氢原子数偏小.
(5)已知氰酸(HCN)的结构简式为H-C≡N,氰胺的结构简式为H2N一C≡N,三聚氰胺分子中每个原子的最外层电子数均为8或2,则其结构简式为 .
.

(1)写出A装置中发生反应的化学方程式:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑或2KMnO4$\frac{\underline{\;△\;}}{\;}$K2MnO4+MnO2+O2↑;
(2)C装置能不能与D装置互换?不能,(填“能”或“不能”),理由是浓硫酸吸水,碱石灰吸收二氧化碳,若互换位置,则碱石灰会同时吸收水和二氧化碳,导致实验失败
(3)当B装置中反应完全发生后,读取F中水的体积,实验操作顺序为②③①(填序号).
①读数 ②冷却至室温 ③调平E、F装置中液面
(4)测定数据如表:
| 仪器 | C | D |
| 实验前 | 101.0g | 56.0g |
| 试验后 | 106.4g | 69.2g |
①利用上述实验数据,通过计算可知三聚氰胺的实验式为CN2H2.
②三聚氰胺的分子式为C3N6H6.
③若装置中没有铜网,则对测定结果的影响是测定所得分子式的氮原子数偏大,而碳、氢原子数偏小.
(5)已知氰酸(HCN)的结构简式为H-C≡N,氰胺的结构简式为H2N一C≡N,三聚氰胺分子中每个原子的最外层电子数均为8或2,则其结构简式为
 .
. 