题目内容
工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3、SiO2等杂质)提取氧化铝,操作过程如图:
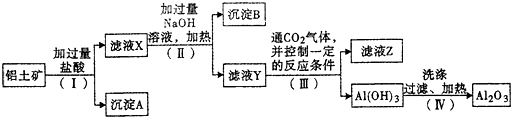
(1)沉淀A中主要含有 .若步骤(Ⅰ)改加氢氧化钠溶液,沉淀A (填“能”或“不能”)发生反应,若能发生反应,则反应的化学方程式为 .
(2)滤液X中,除了Fe3+、H+外,还含有的阳离子是
(3)(Ⅱ)步骤中分离溶液和沉淀的操作名称是
(4)写出(Ⅳ)步骤反应的化学方程式 ,Al2O3属于 氧化物 (填“酸性”或“碱性”或“两性”).
(5)滤液Y中除NaCl和NaOH外,还含有的溶质为 (填化学式)

(1)沉淀A中主要含有
(2)滤液X中,除了Fe3+、H+外,还含有的阳离子是
(3)(Ⅱ)步骤中分离溶液和沉淀的操作名称是
(4)写出(Ⅳ)步骤反应的化学方程式
(5)滤液Y中除NaCl和NaOH外,还含有的溶质为
考点:物质分离和提纯的方法和基本操作综合应用,镁、铝的重要化合物
专题:实验题,几种重要的金属及其化合物
分析:SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能反应,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀.
铝土矿中加入盐酸,沉淀A为SiO2,滤液X中含有AlCl3、FeCl3,加入过量NaOH,沉淀B为Fe(OH)3,滤液Y中含有NaAlO2,通入二氧化碳气体,滤液Z中含有碳酸钠或碳酸氢钠,氢氧化铝在加热分解可生成氧化铝,以此解答该题.
铝土矿中加入盐酸,沉淀A为SiO2,滤液X中含有AlCl3、FeCl3,加入过量NaOH,沉淀B为Fe(OH)3,滤液Y中含有NaAlO2,通入二氧化碳气体,滤液Z中含有碳酸钠或碳酸氢钠,氢氧化铝在加热分解可生成氧化铝,以此解答该题.
解答:
解:铝土矿中加入盐酸,沉淀A为SiO2,滤液X中含有AlCl3、FeCl3,加入过量NaOH,沉淀B为Fe(OH)3,滤液Y中含有NaAlO2,通入二氧化碳气体,滤液Z中含有碳酸钠或碳酸氢钠,氢氧化铝在加热分解可生成氧化铝,
(1)因SiO2与盐酸不反应,则沉淀A为SiO2,如加入氢氧化钠溶液,发生SiO2+2NaOH=Na2SiO3+H2O,
故答案为:SiO2;能; SiO2+2NaOH=Na2SiO3+H2O;
(2)氧化铝与酸反应离子方程式为Al2O3+6H+=2Al3++3H2O,氧化铁与盐酸反应离子方程式为Fe2O3+6H+=2Fe3++3H2O,滤液A中除了Fe3+、H+外,还含有的阳离子是Al3+,故答案为:Al3+;
(3)(Ⅱ)步骤中分离溶液和沉淀,应为过滤操作,故答案为:过滤;
(4)氢氧化铝在加热分解可生成氧化铝,氧化铝为两性氧化物,分解的方程式为2Al(OH)3
Al2O3+3H2O,
故答案为:2Al(OH)3
Al2O3+3H2O;两性;
(5)氢氧化铝具有两性,可与氢氧化钠反应生成Na[Al(OH)4],故答案为:Na[Al(OH)4].
(1)因SiO2与盐酸不反应,则沉淀A为SiO2,如加入氢氧化钠溶液,发生SiO2+2NaOH=Na2SiO3+H2O,
故答案为:SiO2;能; SiO2+2NaOH=Na2SiO3+H2O;
(2)氧化铝与酸反应离子方程式为Al2O3+6H+=2Al3++3H2O,氧化铁与盐酸反应离子方程式为Fe2O3+6H+=2Fe3++3H2O,滤液A中除了Fe3+、H+外,还含有的阳离子是Al3+,故答案为:Al3+;
(3)(Ⅱ)步骤中分离溶液和沉淀,应为过滤操作,故答案为:过滤;
(4)氢氧化铝在加热分解可生成氧化铝,氧化铝为两性氧化物,分解的方程式为2Al(OH)3
| ||
故答案为:2Al(OH)3
| ||
(5)氢氧化铝具有两性,可与氢氧化钠反应生成Na[Al(OH)4],故答案为:Na[Al(OH)4].
点评:本题以框图题形式考查铝的化合物的性质,为高频考点,侧重于学生的分析能力和实验能力的考查,难度中等,清楚冶炼铝工艺流程原理,是对知识迁移的综合运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
利用下列实验装置进行的相应实验,不能达到实验目的是( )


| A、图1所示装置可制取乙炔 |
| B、图2所示装置可分离乙酸乙酯和醋酸钠的水溶液 |
| C、图3所示装置可制取乙烯并验证其易被氧化 |
| D、图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6g,当其缓慢经过无水CaCl2时,CaCl2增重25.2g.甲烷的质量为( )
| A、12.5g |
| B、13.2g |
| C、11.2g |
| D、24.4g |
 Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?
Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?