题目内容
填空
(1)0.5mol H2O中含有 个氧原子, 个氢原子(填具体数字)
(2)12.4g Na2X中含Na+0.4mol,则Na2X的摩尔质量为 ,X的相对原子质量为 .
(3)3.6g水中所含分子数与 g硫酸所含的分子数相等.
(1)0.5mol H2O中含有
(2)12.4g Na2X中含Na+0.4mol,则Na2X的摩尔质量为
(3)3.6g水中所含分子数与
考点:物质分子中的原子个数计算,摩尔质量
专题:阿伏加德罗常数和阿伏加德罗定律
分析:(1)0.5mol H2O含有0.5molO、1molH;
(2)根据Na2X的组成计算出Na2X的物质的量及摩尔质量,根据摩尔质量与相对分子量的关系计算出X的相对原子质量;
(3)物质所含分子数相等则说明分子的物质的量是相等的.
(2)根据Na2X的组成计算出Na2X的物质的量及摩尔质量,根据摩尔质量与相对分子量的关系计算出X的相对原子质量;
(3)物质所含分子数相等则说明分子的物质的量是相等的.
解答:
解:(1)0.5mol H2O含有0.5molO、1molH,因此含有3.01×1023个O、6.02×1023个H,
故答案为:3.01×1023;6.02×1023;
(2)12.4克Na2X中含有0.4molNa+,Na2X的物质的量为:n(Na2X)=
n(Na+)=0.4mol×
=0.2mol,
Na2X的摩尔质量为:M(Na2X)=
=62g/mol,即Na2X的相对原子量为62,X的相对原子质量为:62-23×2=16,
故答案为:62g/mol;16;
(3)物质所含分子数相等则说明分子的物质的量是相等的,3.6g水的物质的量为0.2mol,0.2mol硫酸的质量是0.2mol×98g/mol=19.6g,
故答案为:19.6.
故答案为:3.01×1023;6.02×1023;
(2)12.4克Na2X中含有0.4molNa+,Na2X的物质的量为:n(Na2X)=
| 1 |
| 2 |
| 1 |
| 2 |
Na2X的摩尔质量为:M(Na2X)=
| 12.4g |
| 0.2mol |
故答案为:62g/mol;16;
(3)物质所含分子数相等则说明分子的物质的量是相等的,3.6g水的物质的量为0.2mol,0.2mol硫酸的质量是0.2mol×98g/mol=19.6g,
故答案为:19.6.
点评:本题考查常用化学计量的有关计算,题目计算量很大,侧重对基础公式的运用,难度不大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
下列关于电解质溶液的叙述正确的是( )
| A、常温下,由0.1mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在:BOH?B++OH- |
| B、常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C、中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D、将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
下列说法正确的是( )
| A、NaOH溶于水共价键被破坏 |
| B、稀有气体的原子间存在共价键 |
| C、二氧化碳分子的结构式:O═C═O |
| D、MgF2、H2O2含有的化学键类型相同 |
往下列溶液中滴加FeCl3溶液,无变化的是( )
A、 |
B、 |
C、 |
| D、氢碘酸 |
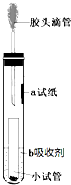 一位同学设计了一套微型装置(如图),用来完成下列实验.
一位同学设计了一套微型装置(如图),用来完成下列实验.