题目内容
 Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?
Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?(1)夏天的食品易变霉,在冬天不易发生该现象
(2)同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气体有快有慢
(3)MnO2加入双氧水中放出气泡更快
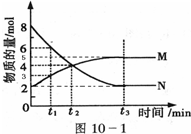
Ⅱ:在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
(1)比较t2时刻,正逆反应速率大小V正
(2)若t2=2min,计算反应开始至t2时刻用M的浓度变化表示的平均反应速率为:
(3)t3时刻化学反应达到平衡,反应物的转化率为
(4)如果升高温度,则V逆
考点:物质的量或浓度随时间的变化曲线,化学反应速率的影响因素
专题:化学平衡专题,化学反应速率专题
分析:Ⅰ:影响化学反应速率的主要因素为物质本身性质,而常见影响化学反应速率的外界因素有浓度、温度、催化剂以及固体表面积大小等,结合题给信息解答该题.
Ⅱ:由图象可知,随着反应进行,N的物质的量减少,M的物质的量增加,所以,N是反应物,M是生产物,随时间进行,N的物质的量为定值且不为零,反应为可逆反应,且△n(N):△n(M)=(8-2)mol:(5-2)mol=2:1,则反应的化学方程式为:2N M;结合v=
M;结合v=
计算反应速率v(M);结合对应数据计算转化率等,以此解答该题.
Ⅱ:由图象可知,随着反应进行,N的物质的量减少,M的物质的量增加,所以,N是反应物,M是生产物,随时间进行,N的物质的量为定值且不为零,反应为可逆反应,且△n(N):△n(M)=(8-2)mol:(5-2)mol=2:1,则反应的化学方程式为:2N
 M;结合v=
M;结合v=| △c |
| △t |
解答:
解:Ⅰ:(1)夏天温度较高,反应速率较大,而冬天温度较低,反应速率较低,故答案为:温度;
(2)反应物本身性质是影响化学反应速率的主要因素,镁比锌活泼,与盐酸反应较剧烈,故答案为:反应物本身性质;
(3)二氧化锰为反应的催化剂,可加快反应速率,故答案为:催化剂;
Ⅱ:(1)t2时刻,反应物逐渐减小,生成物逐渐增多,则反应向正向移动,V正>V逆,故答案为:>;
(2)v=
=
=0.25mol/(L?min),故答案为:0.25mol/(L?min);
(3)t3时刻化学反应达到平衡,剩余2molN,则转化6molN,转化率为
×100%=75%,
故答案为:75%;
(4)升高温度,反应速率增多,故答案为:增大.
(2)反应物本身性质是影响化学反应速率的主要因素,镁比锌活泼,与盐酸反应较剧烈,故答案为:反应物本身性质;
(3)二氧化锰为反应的催化剂,可加快反应速率,故答案为:催化剂;
Ⅱ:(1)t2时刻,反应物逐渐减小,生成物逐渐增多,则反应向正向移动,V正>V逆,故答案为:>;
(2)v=
| △c |
| △t |
| ||
| 2min |
(3)t3时刻化学反应达到平衡,剩余2molN,则转化6molN,转化率为
| 8mol-2mol |
| 8ml |
故答案为:75%;
(4)升高温度,反应速率增多,故答案为:增大.
点评:本题考查较为综合,涉及化学反应速率的影响因素以及平衡图象知识,为高频考点,侧重于基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
原电池产生电流的本质原因是( )
| A、原电池中溶液能电离出自由移动的离子 |
| B、有导线将两个活动性不同的电极连接 |
| C、正极发生了氧化反应,而负极发生了还原反应 |
| D、两电极上分别进行的氧化、还原反应中会有电子的转移 |
 喷泉是一种常见的自然现象,如图是化学教材中常用的喷泉实验装置(夹持仪器已略去),在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体;下列气体和液体的组合中不可能形成喷泉的是( )
喷泉是一种常见的自然现象,如图是化学教材中常用的喷泉实验装置(夹持仪器已略去),在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体;下列气体和液体的组合中不可能形成喷泉的是( )| A、HCl和H2O |
| B、O2和H2O |
| C、NH3和H2O |
| D、CO2和NaOH溶液 |
 丁达尔效应是区分胶体与溶液的一种最常用的方法.
丁达尔效应是区分胶体与溶液的一种最常用的方法.

 一位同学设计了一套微型装置(如图),用来完成下列实验.
一位同学设计了一套微型装置(如图),用来完成下列实验.