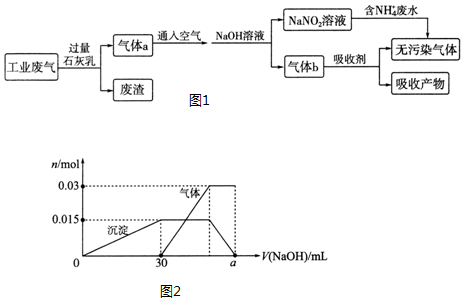
题目内容
4.下列变化属于化学变化的是( )| A. | 蜡烛燃烧 | B. | 活性炭吸附冰箱中的异味 | ||
| C. | 分离液态空气制氧气 | D. | 海水晒盐 |
分析 A.蜡烛燃烧生成二氧化碳、水等;
B.活性炭具有疏松多孔的结构,可吸附除杂;
C.氧气与氮气的沸点不同;
D.海水晒盐为蒸发原理,水的沸点低.
解答 解:A.蜡烛燃烧生成二氧化碳、水等,有新物质生成,为化学变化,故A选;
B.活性炭具有疏松多孔的结构,可吸附冰箱中的异味,为物理变化,故B不选;
C.氧气与氮气的沸点不同,则分离液态空气制氧气,无新物质生成,为物理变化,故C不选;
D.海水晒盐为蒸发原理,水的沸点低,温度高水挥发与盐分离,无新物质生成,则海水晒盐为物理变化,故D不选;
故选A.
点评 本题考查物质的性质及变化,为高频考点,把握物质的性质、发生的反应、混合物分离、性质与用途的关系为解答关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度,在实验室中进行如下实验,请完成下列填空:
(1)配制100mL 0.10mol/L NaOH标准溶液.
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如表.
①滴定达到终点的现象是加入最后一滴氢氧化钠溶液,溶液由无色恰好变成浅红色,且半分钟内不褪色,此时锥形瓶内溶液的pH为8.2~10.
②根据上述数据,可计算出该盐酸的浓度约为0.1136mol/L(保留两位有效数字)
③排去碱式滴定管中气泡的方法应采用操作丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
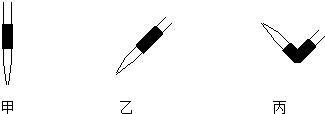
(1)配制100mL 0.10mol/L NaOH标准溶液.
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如表.
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.1136mol/L(保留两位有效数字)
③排去碱式滴定管中气泡的方法应采用操作丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.

15.化学理论在元素单质及其化合物反应中应用广泛.
(1)在一定条件下,可逆反应mA?nB+pC△H,达到平衡状态.
①若A、B、C都是气体,增大压强,平衡向正反应方向移动,则m大于n+p(填“大于”、“小于”或“等于”).
②其他条件不变,加热后A的质量减小,则反应△H大于0(填“大于”、“小于”或“等于”).
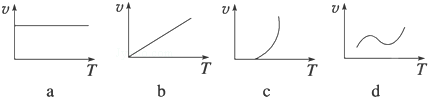
(2)某些金属氧化物(如FexOy)粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是c(填序号).
(3)一定温度下,发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H.已知该反应在不同温度下的平衡常数如表:
请回答下列问题:
①反应的△H<0(填“>”、“<”或“=”).
②T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为w1,c(CO2)=0.15mol•L-1,则温度T低于(填“高于”、“低于”或“等于”)1000,若此时保持其它条件不变再充入2.0mol CO(g),再达平衡时测得CO转化率为w2,则w1=w2(填“>”、“<”或“=”).
(1)在一定条件下,可逆反应mA?nB+pC△H,达到平衡状态.
①若A、B、C都是气体,增大压强,平衡向正反应方向移动,则m大于n+p(填“大于”、“小于”或“等于”).
②其他条件不变,加热后A的质量减小,则反应△H大于0(填“大于”、“小于”或“等于”).
(2)某些金属氧化物(如FexOy)粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是c(填序号).

(3)一定温度下,发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H.已知该反应在不同温度下的平衡常数如表:
| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
①反应的△H<0(填“>”、“<”或“=”).
②T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为w1,c(CO2)=0.15mol•L-1,则温度T低于(填“高于”、“低于”或“等于”)1000,若此时保持其它条件不变再充入2.0mol CO(g),再达平衡时测得CO转化率为w2,则w1=w2(填“>”、“<”或“=”).
19.在一密闭容器中,反应 mA(g)?nB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
| A. | 平衡向逆反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量分数减小了 | D. | m 小于n |
9.下列离子能大量共存的是( )
| A. | Ba2+、SO42-,Fe3+、K+ | B. | OH-、C1-、Na+ | ||
| C. | NH4+、NO3-、A13+、K+ | D. | HCO3-、SO42-、Na+、H+ |
16.甲、乙是两种常见短周期元素的单质,有关物质的转化关系如图所示.下列有关说法,错误的是( ) 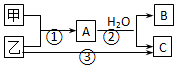

| A. | 若C为酸性气体,则B可能具有两性 | |
| B. | 若C是碱性气体,则B一定是碱 | |
| C. | 若B、C是两种酸,则B、C一定都是一元酸 | |
| D. | 以上3个转变可能都是氧化还原反应 |
14.下列叙述正确的是( )
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 25℃时,0.1mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力相当 | |
| D. | 25℃时,将等体积pH=1的盐酸和和水混合,混合后溶液的pH=1.3 |
 肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题:
肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题: