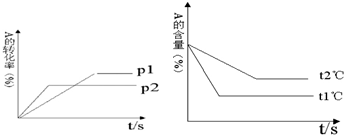
题目内容
室温时,浓度都为0.1mol/L的HA、HC、HD三种一元酸溶液,其中HA溶液中c(H+)=0.01mol/L,HC的pH值为3,HD溶液中c(OH-)=10-13mol/L,则三种酸对应的钠盐在物质的量浓度和温度相同的条件下,溶液的pH值由大到小的顺序为( )
| A、NaA>NaC>NaD |
| B、NaC>NaA>NaD |
| C、NaD>NaA>NaC |
| D、NaC>NaD>NaA |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:室温下浓度为0.1mol/L的三种一元酸溶液:HA、HC、HD,其中HA的c(H+)=0.01mol/L;HC的pH值为3,则HC中氢离子浓度为0.001mol/L;
HD溶液中c(OH-)=1×10-13mol/L,HC中c(H+)=
=0.1mol/L,则HD完全电离,为强酸,则HA、HC、HD的酸性大小为:HD>HA>HC;
酸的酸性越强,其钠盐中的酸根离子水解程度越小,则相同浓度的钠盐溶液的pH越小,据此分析解答.
HD溶液中c(OH-)=1×10-13mol/L,HC中c(H+)=
| 1×10-14 |
| 1×10-13 |
酸的酸性越强,其钠盐中的酸根离子水解程度越小,则相同浓度的钠盐溶液的pH越小,据此分析解答.
解答:
解:室温时,浓度为0.1mol/L的三种一元酸溶液:HA、HC、HD,其中HA的c(H+)=0.01mol/L;HC的pH值为3,则HC中氢离子浓度为0.001mol/L;
HD溶液中c(OH-)=1×10-13mol/L,HC中c(H+)=
=0.1mol/L,则HD完全电离,为强酸,
则HA、HC、HD的酸性大小为:HD>HA>HC;
酸的酸性越强,其酸根离子水解程度越小,则相同浓度的钠盐溶液的pH越小,所以酸根离子水解程度C->A-,
则室温下三种酸所形成的钠盐:NaA、NaC、NaD,在浓度相同的条件下,其pH值由大到小的顺序为:NaC>NaA>NaD,
故选B.
HD溶液中c(OH-)=1×10-13mol/L,HC中c(H+)=
| 1×10-14 |
| 1×10-13 |
则HA、HC、HD的酸性大小为:HD>HA>HC;
酸的酸性越强,其酸根离子水解程度越小,则相同浓度的钠盐溶液的pH越小,所以酸根离子水解程度C->A-,
则室温下三种酸所形成的钠盐:NaA、NaC、NaD,在浓度相同的条件下,其pH值由大到小的顺序为:NaC>NaA>NaD,
故选B.
点评:本题考查了盐类水解原理及其应用,吗难度中等,注意掌握盐的水解原理及其影响因素,明确酸的酸性强弱与酸根离子水解程度关系及酸根离子水解程度与溶液pH的关系是解本题关键.

练习册系列答案
相关题目
PCl3和PCl5都是重要的化工原料.将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)?PCl5(g).有关数据如下:
下列判断不正确的是( )
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
| A、10min内,v(Cl2)=0.04mol/(L?min) |
| B、当反应达到平衡时,容器中Cl2为1.2mol |
| C、升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大 |
| D、平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)=0.2mol/L |
下列叙述正确的是( )
| A、分子式为C4H8有机物最多存在4个C-C单键 |
B、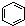 和 和 均是芳香烃, 均是芳香烃, 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 |
C、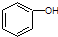 和 和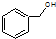 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
| D、乙酸分子中含有碳氧双键,所以它能使溴水褪色 |
-定条件下,2SO2(g)+O2(g)?2SO2(g)△H<0.下列有关叙述正确的是( )
| A、升髙温度,v正变大,v逆变小 |
| B、恒温恒容,充入O2,02的转化率升高 |
| C、恒温恒压,充人N2,平衡不移动 |
| D、恒温恒容,平衡前后混合气体的密度保持不变 |
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.已知H-H键键能为436kJ?mol-1,N-H键键能为391kJ?mol-1,根据热化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.则N≡N键的键能( 单位:kJ?mol-1 )是( )
| A、431 | B、649 |
| C、896 | D、945.6 |
 工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )
工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )| A、曲线Ⅱ对应的条件改变是降低压强 |
| B、若曲线I对应的条件改变是升高温度,则该反应△H>0 |
| C、反应开始至a点时v(H2)=1mol?L-1?min-1 |
| D、其它条件不变,若降低该反应的温度,平衡常数值将减小 |
设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温下,46g NO2中含有氧原子个数为2NA |
| B、在标准状况下,22.4 L丙烷中所含C-H键数目为6NA |
| C、将58.5g NaCl溶于1 L水中,溶液中所含Na+和Cl-总数为2NA |
| D、以二氧化锰和浓盐酸为原料制备氯气,当生成1mol氯气,电子转移总数为4NA |