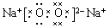题目内容
16.下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不正确的是( )| A. | 淀粉→葡萄糖→CO2和H2O(释放能量维持生命活动) | |
| B. | 纤维素→葡萄糖→CO2和H2O(释放能量维持生命活动) | |
| C. | 油脂→甘油和高级脂肪酸→CO2和H2O(释放能量维持生命活动) | |
| D. | 麦芽糖→葡萄糖→CO2和H2O(释放能量维持生命活动) |
分析 A.淀粉在人体中能水解,能为人体提供能量;
B.人体内没有水解纤维素的酶;
C.油脂能为人体提供能量;
D.麦芽糖能水解,为人体提供能量.
解答 解:A.淀粉在淀粉酶的作用下水解生成葡萄糖,葡萄糖被氧化能释放出能量,故A正确;
B.纤维素不是人体所需要的营养物质,人体内没有水解纤维素的酶,它在人体内主要是加强胃肠蠕动,有通便功能,故B错误;
C.油脂水解生成甘油和高级脂肪酸,甘油和高级脂肪酸能被氧化释放能量,故C正确;
D.麦芽糖能水解生成葡萄糖,葡萄糖在人体中被氧化为人体提供能量,故D正确.
故选B.
点评 本题考查基本营养物质在体内的化学反应,难度不大,注意纤维素不是人体所需要的营养物质,人体内没有水解纤维素的酶,它在人体内主要是加强胃肠蠕动,有通便功能.

练习册系列答案
相关题目
2.在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的主要作用力依次是( )
| A. | 范德华力、范德华力、氢键 | B. | 范德华力、范德华力、共价键 | ||
| C. | 共价键、共价键、共价键 | D. | 范德华力、氢键、共价键 |
7. 生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.
生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.
(1)已知:①2CH3OH(l)+3O2(g)﹦2CO2(g)+4H2O(g)△H=-1275.6KJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0KJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(2)由生物质能获得的CO和H2,可以合成多种有机物.当CO和H2以物质的量之比1:1进行催化反应,其原子利用率达100%,合成的物质可能是cd
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
①下列对该反应的有关说法不正确的是a
a.当v(CO)=2v(H2)时,该反应处于平衡状态
b.恒温恒压下,容器内气体的密度不再改变时,表明反应达到平衡状态
c.在原平衡体系中充入一定量的氦气,平衡可能发生移动
d.恒温恒压下,改变反应物的投入量,△H的值不发生变化
e.温度一定时,缩小容器的体积,平衡将向右移动,c(CO)将变大
②若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
下列判断正确的是ac.
a.c3>2c1=2c2
b.Q1+Q2=90.8 Q3=2Q1
c.K1=K2=K3
d.a2+a3<100%
(4)CO和H2催化合成二甲醚的反应为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),一定温度下,在1L密闭容器中充入3molH2和3molCO进行反应,若用po表示该体系开始时的总压强,p表示平衡时的总压强,则平衡时CO的转化率为$\frac{3(p-{p}_{0})}{2{p}_{0}}$×100%(用po、p的式子表示)
(5)如图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+.
 生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.
生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.(1)已知:①2CH3OH(l)+3O2(g)﹦2CO2(g)+4H2O(g)△H=-1275.6KJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0KJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(2)由生物质能获得的CO和H2,可以合成多种有机物.当CO和H2以物质的量之比1:1进行催化反应,其原子利用率达100%,合成的物质可能是cd
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
①下列对该反应的有关说法不正确的是a
a.当v(CO)=2v(H2)时,该反应处于平衡状态
b.恒温恒压下,容器内气体的密度不再改变时,表明反应达到平衡状态
c.在原平衡体系中充入一定量的氦气,平衡可能发生移动
d.恒温恒压下,改变反应物的投入量,△H的值不发生变化
e.温度一定时,缩小容器的体积,平衡将向右移动,c(CO)将变大
②若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH平衡时浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | a1 | a2 | a3 |
a.c3>2c1=2c2
b.Q1+Q2=90.8 Q3=2Q1
c.K1=K2=K3
d.a2+a3<100%
(4)CO和H2催化合成二甲醚的反应为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),一定温度下,在1L密闭容器中充入3molH2和3molCO进行反应,若用po表示该体系开始时的总压强,p表示平衡时的总压强,则平衡时CO的转化率为$\frac{3(p-{p}_{0})}{2{p}_{0}}$×100%(用po、p的式子表示)
(5)如图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+.
1.已知反应:C+H2O(g)═CO+H2,下列关于该反应说法正确的是( )
| A. | 该反应中C失去电子,被还原 | |
| B. | 该反应中氢气得到电子,被还原 | |
| C. | 该反应中,每转移2mole-则生成1mol氢气. | |
| D. | 该反应属于复分解反应 |
5.已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量;②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量;③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量.下列叙述中正确的是( )
| A. | 氢气和氯气反应生成氯化氢气体是放热反应,所以不需要条件就能自发进行 | |
| B. | 氢气和氯气反应生成2 mol氯化氢气体,反应吸收183 kJ的热量 | |
| C. | 氢气和氯气反应生成2 mol氯化氢气体,反应放出183 kJ的热量 | |
| D. | 氢气和氯气反应生成1 mol氯化氢气体,反应放出183 kJ的热量 |
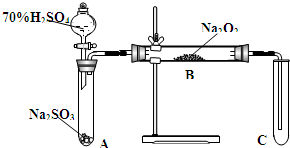 类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用如图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.
类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用如图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.