题目内容
12.某小组为研究电化学原理,设计甲、乙、丙三种装置(C1、C2、C3均为石墨).下列叙述正确的是( )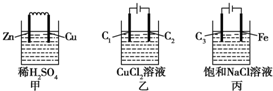
| A. | 甲、丙中是化学能转变为电能,乙中是电能转变为化学能 | |
| B. | C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应 | |
| C. | C1上和C3上放出的气体相同,铜片上和铁片上放出的气体也相同 | |
| D. | 甲、乙、丙中溶液的pH都逐渐升高 |
分析 A.原电池中化学能转化为电能,电解池中电能转化为化学能;
B.与外接电源的正极相连作阳极,与负极相连作阴极,阴极上电极不反应;
C.C1和C3均为阳极,溶液中氯离子失电子,Cu为正极氢离子得电子,Fe作阴极氢离子得电子;
D.甲中氢离子浓度减小,乙中铜离子浓度减小,丙中电解生成氢氧化钠.
解答 解:A.甲为原电池,原电池中化学能转化为电能,乙、丙为电解池,电解池中电能转化为化学能,故A错误;
B.与外接电源的正极相连作阳极,与负极相连作阴极,则C1、C2分别是阳极、阴极,Fe作阴极,阴极上氢离子得电子生成氢气,发生还原反应,故B错误;
C.C1和C3均为阳极,溶液中氯离子失电子,则两个电极上生成的气体相同,Cu为正极氢离子得电子生成氢气,Fe作阴极氢离子得电子生成氢气,故C正确;
D.甲中氢离子浓度减小,溶液的pH增大,乙中电解氯化铜,铜离子浓度减小,铜离子水解生成的氢离子减少,则溶液的pH增大,丙中电解氯化钠溶液生成氢气、氯气和氢氧化钠,溶液的pH增大,故D正确.
故选CD.
点评 本题考查了原电池原理和电解池原理的应用,题目难度中等,注意把握电极的判断方法、溶液中离子的放电顺序等,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
19.运用相关化学知识进行判断,下列结论错误的是( )
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成 H2 的速率 |
3.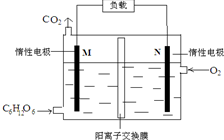 一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能,下列说法中不正确的是( )
一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能,下列说法中不正确的是( )
 一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能,下列说法中不正确的是( )
一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能,下列说法中不正确的是( )| A. | 与等量的C6H12O6完全燃烧放热比较,该装置发电效率高 | |
| B. | 若用该电池电解氧化铝制铝,与N极相连的电极有气体生成 | |
| C. | 电子流向:M→负载→N→电解质溶液→M | |
| D. | 当N极消耗5.6L(标况下)气体时,最多有NA个H+通过阳离子交换膜 |
20.下列说法正确的是( )
| A. | 吸热反应,升高温度,v正增大,v逆减小 | |
| B. | 对于任何化学反应来说,反应速率越大,反应物的转化率越大 | |
| C. | 有气体参与的反应达到平衡后,增大压强,平衡可能不移动 | |
| D. | 选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大 |
7.下列说法中正确的是( )
| A. | 过氧化氢酶在重金属盐的作用下会失去活性 | |
| B. | 油脂的硬化是指含有不饱和键的油脂发生的催化加氢的反应 | |
| C. | 即使条件不同,卤代烷烃与强碱反应生成的有机物也都只有一种 | |
| D. | 有机物都是由碳、氢和氧三种元素组成的,含有碳元素的物质都是有机物 |
17.25°C时某些弱酸的电离平衡常数Ka如下表,下列说法正确的是( )
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同pH的三种酸溶液,物质的量浓度由大到小的顺序为:c(HClO)>c(CH3COOH)>c(H2CO3) | |
| B. | 在相同物质的量浓度的Na2CO3、NaClO、NaHCO3与CH3COONa四种钠盐中加水稀释,水解程度均增大,碱性均增强 | |
| C. | 等物质的量浓度的NaClO和NaHCO3 混合溶液中:c(Na+)=c(HClO)+c(ClO-)+c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | 向次氯酸钠溶液中通入少量二氧化碳气体的离子方程式为:2ClO-+CO2+H2O═CO32-+2HClO |
1.下列过程中,化学平衡不发生移动的是( )
| A. | H2、I2、HI平衡时的混合气体加压后颜色变深 | |
| B. | Na2CrO4溶液中滴加稀硫酸,溶液颜色变深 | |
| C. | 红棕色的NO2加压后颜色先变深后逐渐变浅 | |
| D. | 向氯水中加入适量石灰石,氯水的杀菌能力增强 |
2.利用下列实验装置完成相应的实验,能达到实验目的是( )
| A. |  称量NaOH固体 | B. |  用酒精提取溴水中的溴 | ||
| C. |  除去水中的氯化钠 | D. |  从Y进气收集Cl2 |