题目内容
14.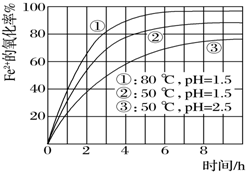 为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )
为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )| A. | pH越小氧化率越小 | |
| B. | 温度越高氧化率越大 | |
| C. | Fe2+的氧化率除受pH、温度影响外,还受其它因素影响,如浓度等 | |
| D. | 实验说明降低pH、升高温度有利于提高Fe2+的氧化率 |
分析 由图象知,当pH值等其它条件相同温度不同时,温度越高Fe2+的氧化率越大;当温度和其它条件相同PH值不同时,pH值越大,Fe2+的氧化率越小,据此分析解答.
解答 解:A.根据图象知,只有当温度和其它条件相同PH值不同时,pH值越小,Fe2+的氧化率越大,故A错误;
B.只有当pH值等其它条件相同温度不同时,温度越高Fe2+的氧化率越大,故B正确;
C.亚铁离子的氧化率不仅和温度、pH有关,还与离子的浓度等其它因素有关,故C正确;
D.根据图象知,降低pH、升高温度亚铁离子的氧化率增大,故D正确;
故选A.
点评 本题考查了外界条件对Fe2+氧化率的影响,难度不大,注意比较氧化率时,必须是其它条件相同只有一个条件不同时才能比较,否则无法得出结论.

练习册系列答案
相关题目
9.二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:H2S+Na2CO3═NaHS+NaHCO3.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)△H=-246.4KJ•mol-1;
则该反应D.
A.任何温度下都能进行 B.任何温度下都不能进行
C.高温下能自发进行 D.低温下能自发进行
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是ce(以上都填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04 mol•L-1.
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:H2S+Na2CO3═NaHS+NaHCO3.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)△H=-246.4KJ•mol-1;
则该反应D.
A.任何温度下都能进行 B.任何温度下都不能进行
C.高温下能自发进行 D.低温下能自发进行
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是ce(以上都填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04 mol•L-1.
19.下列装置不可用于NH3的尾气吸收的是( )
| A. |  | B. |  | C. |  | D. |  |
3.下列说法中不正确的是( )
| A. | 乙烯聚合为聚乙烯高分子材料符合绿色化学原子经济性要求 | |
| B. | 银制品久置干燥空气中因电化学腐蚀而使表面变暗 | |
| C. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| D. | 在合成洗涤剂中添加酶制剂可以提高洗涤效果 |
4.化学式为N2H6SO4的某晶体,其晶体类型与硫酸铵相同,则N2H6SO4晶体中不存在( )
| A. | 离子键 | B. | 共价键 | C. | 分子间作用力 | D. | 阳离子 |