题目内容
3.现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子 Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种.(1)某同学通过分析,认为无需检验就可判断其中必有的两种物质是Na2CO3和Ba(OH)2(填化学式,且相对分子质量小的填在前面)
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时也产生红褐色沉淀,向该沉淀中滴入稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解.则X为B;
A.SO32-B.SO42-C.CH3COO-D.SiO32-
(3)B的水溶液不显中性,原因是CO32-+H2O?HCO3-+OH-;
(4)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,有关反应的离子方程式为3Cu+8H++2NO3-═3Cu2+2NO↑+4H2O;
(5)若把少量E溶液加入A溶液中,无沉淀生成,则该反应的离子方程式为Al3++4OH-=AlO2-+2H2O.
分析 因Al3+、Mg2+、Fe3+和OH-反应生成沉淀,Al3+、Mg2+、Ba2+、Fe3+和CO32-反应,则不能共存,所以一定存在的物质为Na2CO3和Ba(OH)2,C与B的溶液混合时,产生红褐色沉淀和无色无味气体,沉淀为氢氧化铁、气体为二氧化碳;C与A的溶液混合时产生混合物沉淀,向该沉淀中滴入稀盐酸,沉淀部分溶解,最后留有白色沉淀不再溶解,则B为Na2CO3,A为Ba(OH)2,C为硫酸铁,另两种物质为氯化铝、硝酸镁或氯化镁、硝酸铝,以此来解答.
解答 解:(1)因Al3+、Mg2+、Fe3+和OH-反应生成沉淀,Al3+、Mg2+、Ba2+、Fe3+和CO32-反应,则不能共存,所以一定存在的物质为Na2CO3和Ba(OH)2,
故答案为:Na2CO3;Ba(OH)2;
(2)根据C与B的溶液混合时,产生红褐色沉淀和无色无味气体,可知沉淀为氢氧化铁、气体为二氧化碳,则B为Na2CO3,A为Ba(OH)2;C与A的溶液混合时产生混合物沉淀,向该沉淀中滴入稀盐酸,沉淀部分溶解,最后留有白色沉淀不再溶解,则C为硫酸铁,另两种物质为氯化铝、硝酸镁或氯化镁、硝酸铝,因C为Fe2(SO4)3,则阴离子有SO42-,则X为SO42-,
故答案为:B;
(3)B为Na2CO3,水解显碱性,水解离子反应为CO32-+H2O?HCO3-+OH-,故答案为:CO32-+H2O?HCO3-+OH-;
(4)将Cu投入D溶液中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,该气体为NO2,说明D中含有NO3-,反应离子方程式为:3Cu+8H++2NO3-═3Cu2+2NO↑+4H2O,2NO+O2=2NO2,
故答案为:3Cu+8H++2NO3-═3Cu2+2NO↑+4H2O;
(5)少量E溶液加入A溶液中,无沉淀生成,则E中含Al3+,则该反应的离子方程式为Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O.
点评 本题以离子的共存及离子反应考查推断,把握离子之间的反应推断出存在离子是解答的关键,注意氧化还原反应及与量有关的离子反应分析,题目难度中等.

 阅读快车系列答案
阅读快车系列答案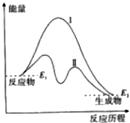
| A. | 曲线Ⅰ和曲线Ⅱ分别表示两个化学反应的能量变化 | |
| B. | 曲线Ⅱ可表示反应2NH3$?_{高温高压}^{催化剂}$N2+3H2的能量变化 | |
| C. | 该反应不需要加热就能发生 | |
| D. | 该反应的△H=E2-E1 |
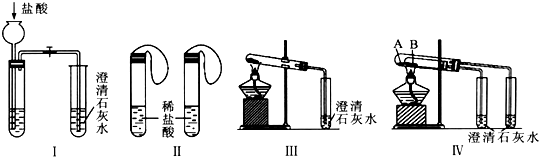
(1)若用实验Ⅳ来验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是NaHCO3,实验现象是右边试管中的石灰水不变浑浊,而左边试管中的石灰水变浑浊.
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的是Ⅱ、Ⅲ、Ⅳ(填装置序号).其中能够说明泡沫灭火器中选择碳酸氢钠与酸反应制CO2而不选择碳酸钠的实验是Ⅱ.
(3)若测定Na2CO3固体中混有的少量NaHCO3的质量分数,Ⅲ能否达到实验目的?若能,请说明其计算所需的数据能;若不能,请简要说明理由固体样品的质量和沉淀总质量(或反应前后固体的质量).
(4)同学们将两种固体分别配制成0.5 mol•L-1的溶液,设计如下方案并对反应现象作出预测:
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol•L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2++CO32-=CaCO3↓(写离子方程式) |
| 操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol•L-1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
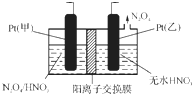 氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.
氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.
 硼及其化合物在耐高潮合金工业、催化剂制造、高能燃料等方面有广泛应用.
硼及其化合物在耐高潮合金工业、催化剂制造、高能燃料等方面有广泛应用. .
.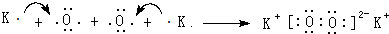 (用元素符号表示).
(用元素符号表示).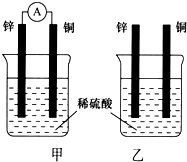 分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,甲中A为电流表.请回答下列问题:
分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,甲中A为电流表.请回答下列问题: