题目内容
在下列物质转化中,反应条件和部分产物已略去.
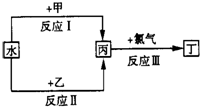
(1)若甲、乙是化合物,且反应Ⅲ是工业制造漂白粉的反应:
①若反应Ⅱ是化合反应,乙可与硫酸铵共热反应制氨气,则此反应的化学方程式为
②反应Ⅲ的化学方程式为 ,在工业生产中,选择丙溶液还是丙悬浊液来吸收氯气: ,理由是 .
(2)若甲、乙是两种常见的金属,反应Ⅲ是工业制盐酸的反应.
①反应Ⅱ中,乙与水在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式为 .工业上制备乙单质的一般方法是 .A、热分解法B、热还原法C、电解法D、物理法
②反应Ⅰ中,甲在通常条件下和水剧烈反应,除丙外,还生成一种透过蓝色钴玻璃片观察到焰色反应呈紫色的物质,在小烧杯里进行甲与水反应的实验,注意事项是 ,观察到的主要现象是 .
③通过比较反应Ⅰ、Ⅱ的反应条件,可得出甲的金属性比乙的金属性 (填“强”或弱).
(3)若甲、乙都是由两种短周期元素组成的离子化合物,反应Ⅲ用于制盐酸.
①反应Ⅰ在常温下进行,除丙外,还有一种产物是可溶性弱碱,则甲的化学式为 .
②反应Ⅱ在常温下进行,除丙外,还有一种产物是强碱,则反应Ⅱ的化学方程式为 .

(1)若甲、乙是化合物,且反应Ⅲ是工业制造漂白粉的反应:
①若反应Ⅱ是化合反应,乙可与硫酸铵共热反应制氨气,则此反应的化学方程式为
②反应Ⅲ的化学方程式为
(2)若甲、乙是两种常见的金属,反应Ⅲ是工业制盐酸的反应.
①反应Ⅱ中,乙与水在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式为
②反应Ⅰ中,甲在通常条件下和水剧烈反应,除丙外,还生成一种透过蓝色钴玻璃片观察到焰色反应呈紫色的物质,在小烧杯里进行甲与水反应的实验,注意事项是
③通过比较反应Ⅰ、Ⅱ的反应条件,可得出甲的金属性比乙的金属性
(3)若甲、乙都是由两种短周期元素组成的离子化合物,反应Ⅲ用于制盐酸.
①反应Ⅰ在常温下进行,除丙外,还有一种产物是可溶性弱碱,则甲的化学式为
②反应Ⅱ在常温下进行,除丙外,还有一种产物是强碱,则反应Ⅱ的化学方程式为
考点:无机物的推断
专题:推断题
分析:(1)反应Ⅲ是工业制漂白粉的反应,说明丙为氢氧化钙,中学能与水反应生成氢氧化钙的物质主要有氧化钙、碳化钙等;
(2)反应Ⅲ是工业制盐酸的反应,说明丙是氢气,能与水反应产生氢气的金属有钠、钾、铁等;
(3)反应Ⅲ是工业制盐酸的反应,说明丙是氢气,有一类特殊物质能与水反应生成氢气和碱,这类物质是氢化物,如氢化钠、氢化铵等.
(2)反应Ⅲ是工业制盐酸的反应,说明丙是氢气,能与水反应产生氢气的金属有钠、钾、铁等;
(3)反应Ⅲ是工业制盐酸的反应,说明丙是氢气,有一类特殊物质能与水反应生成氢气和碱,这类物质是氢化物,如氢化钠、氢化铵等.
解答:
解:(1)反应Ⅲ是工业制漂白粉的反应,说明丙为氢氧化钙,中学能与水反应生成氢氧化钙的物质主要有氧化钙、碳化钙等,则:
①若反应Ⅱ是化合反应,则乙为CaO,乙可与硫酸铵共热反应制氨气,则此反应的化学方程式为:CaO+(NH4)2SO4
CaSO4+2NH3↑+H2O,
故答案为:CaO+(NH4)2SO4
CaSO4+2NH3↑+H2O;
②反应Ⅲ的化学方程式为 2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,澄清石灰水中氢氧化钙浓度很小,所得产品浓度很小,不经济,故工业生产中,选择丙悬浊液来吸收氯气,
故答案为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;丙悬浊液;澄清石灰水中氢氧化钙浓度很小,所得产品浓度很小,不经济;
(2)反应Ⅲ是工业制盐酸的反应,说明丙是氢气,能与水反应产生氢气的金属有钠、钾、铁等,则:
①反应Ⅱ中,乙与水在高温下反应,除丙外,还生成一种有磁性的物质,应为Fe与水蒸气反应生成四氧化三铁与氢气,则反应Ⅱ的化学方程式为3Fe+4H2O(g)
Fe3O4+4H2.工业上制备Fe单质的一般方法是热还原法,
故答案为:3Fe+4H2O(g)
Fe3O4+4H2;B;
②反应Ⅰ中,甲在通常条件下和水剧烈反应,除丙外,还生成一种透过蓝色钴玻璃片观察到焰色反应呈紫色的物质,应是K与是反应生成KOH与氢气,在小烧杯里进行K与水反应的实验,注意事项是:烧杯口上盖玻璃片,观察到的主要现象是:剧烈反应,液面气体燃烧并发生轻微的爆炸,
故答案为:烧杯口上盖玻璃片;剧烈反应,液面气体燃烧并发生轻微的爆炸;
③通过比较反应Ⅰ、Ⅱ的反应条件,可得出K的金属性比Fe的金属性强,
故答案为:强;
(3)反应Ⅲ是工业制盐酸的反应,说明丙是氢气,有一类特殊物质能与水反应生成氢气和碱,这类物质是氢化物,如氢化钠、氢化铵等,则:
①反应Ⅰ在常温下进行,除丙外,还有一种产物是可溶性弱碱,则甲的化学式为 NH4H,
故答案为:NH4H;
②反应Ⅱ在常温下进行,除丙外,还有一种产物是强碱,Y为NaH等,则反应Ⅱ的化学方程式为:NaH+H2O=NaOH+H2↑,
故答案为:NaH+H2O=NaOH+H2↑.
①若反应Ⅱ是化合反应,则乙为CaO,乙可与硫酸铵共热反应制氨气,则此反应的化学方程式为:CaO+(NH4)2SO4
| ||
故答案为:CaO+(NH4)2SO4
| ||
②反应Ⅲ的化学方程式为 2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,澄清石灰水中氢氧化钙浓度很小,所得产品浓度很小,不经济,故工业生产中,选择丙悬浊液来吸收氯气,
故答案为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;丙悬浊液;澄清石灰水中氢氧化钙浓度很小,所得产品浓度很小,不经济;
(2)反应Ⅲ是工业制盐酸的反应,说明丙是氢气,能与水反应产生氢气的金属有钠、钾、铁等,则:
①反应Ⅱ中,乙与水在高温下反应,除丙外,还生成一种有磁性的物质,应为Fe与水蒸气反应生成四氧化三铁与氢气,则反应Ⅱ的化学方程式为3Fe+4H2O(g)
| ||
故答案为:3Fe+4H2O(g)
| ||
②反应Ⅰ中,甲在通常条件下和水剧烈反应,除丙外,还生成一种透过蓝色钴玻璃片观察到焰色反应呈紫色的物质,应是K与是反应生成KOH与氢气,在小烧杯里进行K与水反应的实验,注意事项是:烧杯口上盖玻璃片,观察到的主要现象是:剧烈反应,液面气体燃烧并发生轻微的爆炸,
故答案为:烧杯口上盖玻璃片;剧烈反应,液面气体燃烧并发生轻微的爆炸;
③通过比较反应Ⅰ、Ⅱ的反应条件,可得出K的金属性比Fe的金属性强,
故答案为:强;
(3)反应Ⅲ是工业制盐酸的反应,说明丙是氢气,有一类特殊物质能与水反应生成氢气和碱,这类物质是氢化物,如氢化钠、氢化铵等,则:
①反应Ⅰ在常温下进行,除丙外,还有一种产物是可溶性弱碱,则甲的化学式为 NH4H,
故答案为:NH4H;
②反应Ⅱ在常温下进行,除丙外,还有一种产物是强碱,Y为NaH等,则反应Ⅱ的化学方程式为:NaH+H2O=NaOH+H2↑,
故答案为:NaH+H2O=NaOH+H2↑.
点评:本题考查无机物推断,属于开放性题目,需要学生熟练掌握元素化合物知识,(3)为易错点、难点,涉及内容中学基本不接触,难点中等.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
下列分子结构中,所有原子不能都满足最外层为8电子稳定结构的是( )
| A、CO2 |
| B、H2O |
| C、N2 |
| D、CCl4 |
下列原子或离子的基态电子排布式正确的是( )
| A、Ni:[Ar]3d8 |
| B、Cu:[Ar]3d94s2 |
| C、S2-:[Ne]2s23p6 |
| D、Si:[Ne]3s23p2 |
某微粒的核外电子排布式为1s22s22p63s23p6,下列关于该微粒的说法正确的是( )
| A、它的质子数一定是18 |
| B、它的原子和37Cl可能互为同位素 |
| C、它的单质一定是强还原剂 |
| D、可以确定该微粒为Ar |


 结构的物质不能稳定存在.
结构的物质不能稳定存在.
 欲探究氯气与碘单质的氧化性强弱,某同学设计了如图装置(用浓盐酸和KMnO4固体反应制取氯气).
欲探究氯气与碘单质的氧化性强弱,某同学设计了如图装置(用浓盐酸和KMnO4固体反应制取氯气).