题目内容
5.下列指定粒子的个数比为1:1的是( )| A. | NH4+中质子数与电子数 | B. | NH4HSO4晶体中阳离子与阴离子 | ||
| C. | OH-中电子数与中子数 | D. | Na2O2中阳离子与阴离子 |
分析 A.NH4+为带一个正电荷的阳离子,质子数比电子数多一个;
B.NH4HSO4晶体由阳离子NH4+和阴离子HSO4-构成;
C.OH-的电子数为10,中子数为8;
D.Na2O2由钠离子和过氧根离子构成.
解答 解:A.NH4+为带一个正电荷的阳离子,质子数比电子数多一个,故A错误;
B.NH4HSO4晶体中阳离子NH4+和阴离子HSO4-的个数比等于1:1,故B正确;
C.OH-的质子数为8+1=9,电子数为10,中子数为8,故C错误;
D.Na2O2中钠离子与过氧根离子的个数比等于2:1,故D错误;
故选B.
点评 本题考查的是质子数、中子数、电子数之间的关系以及离子化合物中阴阳离子的关系,难度中等,注意Na2O2固体中阴离子是O22-不是O2-.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称.下列有关${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti的说法正确的是( )
| A. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti原子中均含有22个中子 | |
| B. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti在周期表中位置相同,都在第4纵行 | |
| C. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti的物理性质相同 | |
| D. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti为同一核素 |
13.下列化学用语表示正确的是( )
| A. | 乙烯的最简式:CH2═CH2 | |
| B. | Cl-的离子结构示意图: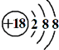 | |
| C. | 二氧化碳的电子式: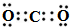 | |
| D. | 原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl |
14.25℃、101kPa 下:
①2Na(s)+$\frac{1}{2}$O2(g)═Na2O(s)△H1=-414KJ/mol
②2Na(s)+O2(g)═Na2O2(s)△H2=-511KJ/mol
下列说法正确的是( )
①2Na(s)+$\frac{1}{2}$O2(g)═Na2O(s)△H1=-414KJ/mol
②2Na(s)+O2(g)═Na2O2(s)△H2=-511KJ/mol
下列说法正确的是( )
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 25℃、101kPa 下,Na2O2(s)+2 Na(s)═2Na2O(s)△H=-317kJ/mol |
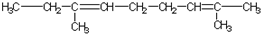
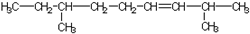
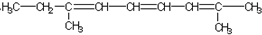
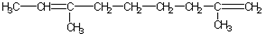

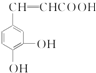 跟碳酸氢钠:
跟碳酸氢钠: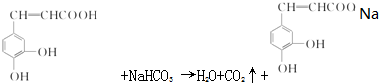 .
.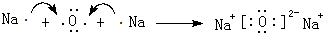 .
.
 ;由F生成一硝基产物的化学方程式为
;由F生成一硝基产物的化学方程式为 .
.