题目内容
11.有四种试剂:①AgNO3 ②HNO3 ③新制Cu(OH)2 ④碘水.为依次鉴别葡萄糖溶液、淀粉溶液、食盐溶液、鸡蛋清溶液,加入上述试剂的正确顺序是( )| A. | ④②①③ | B. | ①③②④ | C. | ③②④① | D. | ③④①② |
分析 葡萄糖含有醛基,可与新制Cu(OH)2发生氧化还原反应;淀粉遇碘变蓝色;AgNO3溶液与含氯离子的物质反应生成白色的沉淀;浓硝酸能使蛋白质呈现黄色,以此来解答.
解答 解:葡萄糖的结构简式为CH2OH(CHOH)4CHO,含有醛基,含有醛基的物质与新制Cu(OH)2悬浊液反应生成砖红色沉淀,可用新制Cu(OH)2发检验葡萄糖;
淀粉溶液与碘水作用显示蓝色,可用碘水检验淀粉;
食盐为氯化钠,在溶液中电离出氯离子,与硝酸银电离出银离子结合,生成白色的氯化银沉淀,可用硝酸银检验食盐溶液;
鸡蛋清是蛋白质,蛋白质遇浓硝酸发生显色反应,可用硝酸检验蛋白质,
则加入上述试剂的正确顺序是③④①②,
故选D.
点评 本题考查物质的检验和鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同为解答该题的关键,题目难度不大.

练习册系列答案
相关题目
1.(1)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如表
上述盐溶液中的阴离子,结合H+能力最强的是CO32-,根据表中数据,浓度均为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填编号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)碳酸氢钠是一种强(填“强”或“弱”)电解质,写出HCO3-水解的离子方程式:HCO3-+H2O?H2CO3+OH-,常温下,0.1mol•L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH- 五种微粒的浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-).
(3)实验室中常用NaOH来进行洗气和提纯.
几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,Cu2+;(填离子符号)先沉淀,要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为6.(KspCu(OH)2=2×10-20mol2•L-2)
(4)难溶电解质FeS在水溶液中存在着溶解平衡:FeS(s)?Fe2+(aq)+S2-(aq),在一定温度Ksp=c(Fe2+)c(S2-)=6.25×10-18,在该温度下,氢硫酸饱和溶液中存在c2(H+)c(S2-)=1.0×10-22.将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)=1.0mol/L,应调节溶液的pH=2.4(已知lg2=0.3)
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)碳酸氢钠是一种强(填“强”或“弱”)电解质,写出HCO3-水解的离子方程式:HCO3-+H2O?H2CO3+OH-,常温下,0.1mol•L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH- 五种微粒的浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-).
(3)实验室中常用NaOH来进行洗气和提纯.
几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
(4)难溶电解质FeS在水溶液中存在着溶解平衡:FeS(s)?Fe2+(aq)+S2-(aq),在一定温度Ksp=c(Fe2+)c(S2-)=6.25×10-18,在该温度下,氢硫酸饱和溶液中存在c2(H+)c(S2-)=1.0×10-22.将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)=1.0mol/L,应调节溶液的pH=2.4(已知lg2=0.3)
19. 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
①可能有C2H4 ②一定没有C2H6 ③一定有C3H8
④一定有CH4 ⑤可能有C2H6 ⑥可能有C2H2.
 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )①可能有C2H4 ②一定没有C2H6 ③一定有C3H8
④一定有CH4 ⑤可能有C2H6 ⑥可能有C2H2.
| A. | ②⑤⑥ | B. | ④⑥ | C. | ①②④ | D. | ②③ |
16.下列4种变化中,有一种变化与其它3种变化类型不同的是( )
| A. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| B. | CH3CH2OH+HBr$\stackrel{△}{→}$C2H5Br+H2O | |
| C. | 2CH3CH2OH$→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O | |
| D. | CH3Cl+Cl2$\stackrel{光照}{→}$CH2Cl2+HCl |
20.用于呼吸面具或潜水艇中提供氧气的物质是( )
| A. | KClO3 | B. | KMnO4 | C. | Na2O2 | D. | H2O |
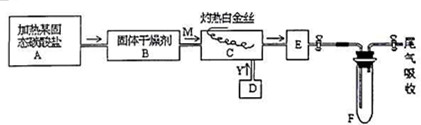
 某化学兴趣小组用如图所示装置进行探究性实验,验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变成棕黑色(棕黑色是浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色)
某化学兴趣小组用如图所示装置进行探究性实验,验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变成棕黑色(棕黑色是浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色) .
. .
.
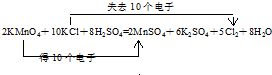
 ,氯原子核外有17不同运动状态的电子.
,氯原子核外有17不同运动状态的电子.