题目内容
17.等质量的下列烃,完全燃烧耗氧量最大的是( )| A. | CH4 | B. | C2H2 | C. | C2H4 | D. | C6H6 |
分析 由C+O2→CO2,4H+O2→2H2O可知,消耗32g氧气需要碳12g,需要H元素4g,故等质量时,有机物含氢量越大,燃烧时消耗氧气越多.
解答 解:A、CH4中C、H原子数目之比为1:4;
B、C2H2中C、H原子数目之比为2:2=1:1;
C、C2H4中C、H原子数目之比为2:4=1:2;
D、C6H6中C、H原子数目之比为4:4=1:1;
故CH4中H的质量分数最大,相同质量甲烷消耗氧气最多,
故选:A.
点评 本题考查学生利用烃燃烧反应进行计算,关键氢元素质量分数越大耗氧量越大,结合相同碳原子数时H原子个数越多氢元素质量分数越大解答,不必利用化学反应方程式进行计算,简化了计算过程.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.某溶液中含有HCO3-、CO32-、SO32-、SO42- Na+、NO3-五种离子.若向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是( )
| A. | NO3-、CO32-、SO42- | B. | NO3- | ||
| C. | SO32-、NO3- | D. | CO32-、NO3-、Na+ |
8.下列说法中正确的是( )
| A. | 元素的种类由原子的质量数决定 | |
| B. | HF、HCl、HBr、HI的还原性从左到右依次减弱 | |
| C. | 第三周期非金属元素所形成的所有含氧酸的酸性从左到右一定依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
12.一定条件下,下列所发生的反应属于取代反应的是( )
| A. | 天然气的燃烧 | B. | 乙烯使溴水褪色 | ||
| C. | 苯与浓硝酸反应 | D. | 溴乙烷与氢氧化钠的醇溶液反应 |
9.既有离子键,又有共价键的化合物是( )
| A. | KBr | B. | NaOH | C. | HBr | D. | N2 |
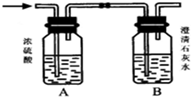 如图所示,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:
如图所示,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题: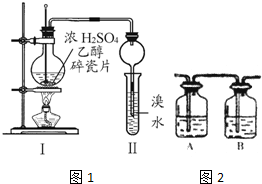 某化学兴趣小组用如图所示装置进行探究性实验,验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变成棕黑色(棕黑色是浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色)
某化学兴趣小组用如图所示装置进行探究性实验,验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变成棕黑色(棕黑色是浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色) .
.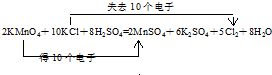 .
.
 ,氯原子核外有17不同运动状态的电子.
,氯原子核外有17不同运动状态的电子.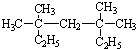 系统命名为3,3,5,5-四甲基庚烷;
系统命名为3,3,5,5-四甲基庚烷; ,B
,B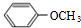 ,C
,C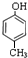 .
.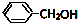 四种有机物能氧化成醛的是AD; 能消去成烯的是BC;
四种有机物能氧化成醛的是AD; 能消去成烯的是BC; 、
、 .
.