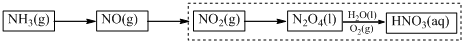题目内容
10.下列有关操作正确的是( )| A. | FeBr3作催化剂,苯和溴水发生反应可生成无色、比水重的液体溴苯 | |
| B. | 用盐酸酸化的高锰酸钾溶液区别苯与甲苯 | |
| C. | 将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,实现乙醇被氧化为乙醛的实验 | |
| D. | 可以用水鉴别硝基苯、乙醇、四氯化碳三种有机物 |
分析 A.苯和溴水不反应;
B.甲苯能被高锰酸钾氧化,苯不能;
C.Cu与氧气反应生成CuO,CuO氧化乙醇生成乙醛;
D.硝基苯、四氯化碳均不溶于水,密度均比水大.
解答 解:A.苯和溴水不反应,应利用苯、液溴发生取代反应制备溴苯,故A错误;
B.甲苯能被高锰酸钾氧化,苯不能,则用盐酸酸化的高锰酸钾溶液区别苯与甲苯,故B正确;
C.铜丝弯成螺旋状,在酒精灯上加热变黑后,Cu与氧气反应生成CuO,将立即伸入盛有无水乙醇的试管中,CuO氧化乙醇生成乙醛,则实现乙醇被氧化为乙醛的实验,故C正确;
D.硝基苯、四氯化碳均不溶于水,密度均比水大,与水混合的分层现象相同,不能鉴别,故D错误;
故选BC.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物鉴别时的现象,题目难度不大.

练习册系列答案
相关题目
1.据报道,月球上存在大量3He,以下有关3He的说法正确的是( )
| A. | 是4He的同分异构体 | B. | 比 4He少一个中子 | ||
| C. | 比4He少一个质子 | D. | 3He原子核有3个质子 |
18.下列各组物质中,表中a→b、b→c的相互转化不能一步完成的是( )
| a | b | c | |
| A | SiO2 | Na2SiO3 | H2SiO3 |
| B | NO | NO2 | HNO3 |
| C | Fe | FeCl3 | Fe(OH)3 |
| D | Al(OH)3 | Na[Al(OH)4] | Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
5.参考表中物质的熔点,回答有关问题.
(1)钠的卤化物及碱金属的氯化物的熔点与卤离子及碱金属离子的离子半径大小有关,随着该值的增大,熔点依次降低.
(2)硅的卤化物及硅、锗、锡、铅的氯化物熔点与相对分子质量有关,随着此值的增大,分子间作用力增大,故熔点依次升高.
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与晶体类型有关.
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SbCl4 | PbCl4 |
| 熔点/℃ | -90.4 | -70.4 | 5.2 | 120 | -70.4 | -49.5 | -36.2 | -15 |
(2)硅的卤化物及硅、锗、锡、铅的氯化物熔点与相对分子质量有关,随着此值的增大,分子间作用力增大,故熔点依次升高.
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与晶体类型有关.
2.设v(正)和v(逆)分别表示可逆反应的正反应速率和逆反应速率.在一定温度下反应X(g)+3Y(g)?2Z(g)达到平衡时,下列有关描述正确的是( )
| A. | 各物质的质量保持不变 | B. | 各物质的浓度相等 | ||
| C. | v(逆)=v(正),正、逆反应停止 | D. | X、Y、Z的速率相等 |
19.甲烷分子中的4个氢原子全部被苯基取代,所得物质的分子结构如图所示,对该物质的描述不正确的是( )
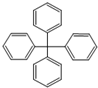

| A. | 其分子式为C25H20 | |
| B. | 分子内的所有碳原子可能共平面 | |
| C. | 完全燃烧生成CO2和H2O的物质的量之比为5:2 | |
| D. | 此分子的一氯代物有三种同分异构体 |
20.下列离子组在溶液中能大量共存的是( )
| A. | Fe3+、SO42-、I-、K+ | B. | K+、Al3+、SO42-、MnO4- | ||
| C. | H+、NO3-、Fe2+、Na+ | D. | Ba2+、NH4+、Br-、OH- |