题目内容
17. 汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.
汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.(1)已知:
①CH4(g)+4NO2(g)$\stackrel{催化剂}{?}$ 4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)$\stackrel{催化剂}{?}$ 2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
③CH4(g)+2NO2(g) $\stackrel{催化剂}{?}$N2(g)+CO2(g)+2H2O(g)
△H3=-867kJ•mol-1.
(2)反应③在热力学上趋势很大,其原因是此反应放出的热量十分大.在固定容器中按一定比例混合CH4与NO2后,提高NO2转化率的反应条件是低温、低压
(3)在130℃和180℃时,分别将0.50mol CH4和a mol NO2充入1L的密闭容器中发生反应③,测得有关数据如表:
| 实验编号 | 温度 | 0分钟 | 10分钟 | 20分钟 | 40分钟 | 50分钟 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
②130℃时,反应到20分钟时,NO2的反应速率是0.0125mol/(L•min).
③180℃时达到平衡状态时,CH4的平衡转化率为70%.
④已知130℃时该反应的化学平衡常数为6.4,试计算a=1.2.
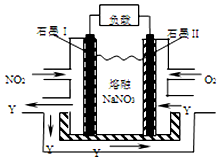
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图.该电池在使用过程中石墨I电极上生成氧化物Y,该电极反应为NO2+NO3--e-=N2O5.
分析 (1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1,(①+②)×$\frac{1}{2}$得CH4(g)+2NO2(g) $\stackrel{催化剂}{?}$N2(g)+CO2(g)+2H2O(g))△H=-867kJ•mol-1,据此进行分析;
(2)依据热化学方程式方向可知,该反应放热量大,即反应物和生成物的能量差大,因此热力学趋势大;有利于提高NO2转化率的反应条件是需要改变条件使平衡正向进行;
(3)①根据实验1、2的不同点确定实验目的;
②据v=$\frac{△c}{△t}$进行计算;
③甲烷的转化率=$\frac{(0.5-0.15)mol}{0.5mol}$=70%;
④根据平衡常数计算a;
(4)该原电池中通入二氧化氮的电极是负极、通入氧气的电极是正极,所以I是负极、II是正极,负极上生成氧化物,应该是二氧化氮失电子和硝酸根离子反应生成五氧化二氮.
解答 解:(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1,(①+②)×$\frac{1}{2}$得CH4(g)+2NO2(g) $\stackrel{催化剂}{?}$N2(g)+CO2(g)+2H2O(g))△H=-867kJ•mol-1,
故答案为:-867kJ•mol-1;
(2)反应③在热力学上趋势很大,该反应放出热热量大,即反应物和生成物的能量差大,因此热力学趋势大;该反应为气体体积增大的放热反应,所以降低温度、降低压强有利于提高NO2转化率;
故答案为:此反应放出的热量十分大;低温、低压;
(3)①实验中只有温度不同,所以实验目的是:研究温度对该化学平衡的影响,
故答案为:研究温度对该化学平衡的影响;
②v=$\frac{△c}{△t}$=$\frac{\frac{0.5mol-0.25mol}{1L}}{20min}$=0.0125mol/(L•min),
故答案为:0.0125mol/(L•min);
③甲烷的转化率=$\frac{(0.5-0.15)mol}{0.5mol}$=70%,
故答案为:70%;
④设二氧化氮的物质的量为a,
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)
C0(mol/L):0.5 a 0 0 0
△C(mol/L):0.40 0.80 0.40 0.40 0.80
C平(mol/L):0.10 a-0.80 0.40 0.40 0.80
则:$\frac{0.40×0.40×(0.80)^{2}}{0.10×(a-0.80)}$,a=1.2,
故答案为:1.2;
(4)该原电池中通入二氧化氮的电极是负极、通入氧气的电极是正极,所以I是负极、II是正极,负极上生成氧化物,应该是二氧化氮失电子和硝酸根离子反应生成五氧化二氮,电极反应式为NO2+NO3--e-=N2O5,
故答案为:NO2+NO3--e-=N2O5.
点评 【点评】本题考查反应热的计算、化学平衡的判断、反应速率、转化率的计算、电极方程式的书写,本题难度不大.

 名校课堂系列答案
名校课堂系列答案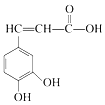
| A. | 与咖啡酸的物质类别完全相同(含咖啡酸),且苯环上只有3个取代基的同分异构体(包括顺反异构)有18种 | |
| B. | 1mol咖啡酸最多可与3molBr2反应 | |
| C. | 咖啡酸与 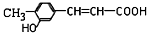 互为同系物 互为同系物 | |
| D. | 1mol咖啡酸与足量NaHCO3溶液反应产生3mol气体 |
| A. | HNO3 | B. | AgNO3 | C. | HCl | D. | H2SO4 |
(1)已知:N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1
| 化学犍 | O=O | C=0 | C≡O |
| 键能(kJ•mol-1) | 497 | 803 | 1072 |
| A. | 中子数为8的氮原子${\;}_{7}^{8}$N | |
| B. | 钠原子的结构示意图: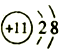 | |
| C. | 氧化钠的电子式: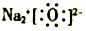 | |
| D. | 2-戊烯的结构简式:CH3CH2CH═CHCH3 |
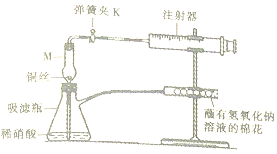 某化学兴趣小组对铜与硝酸的反应进行下列探究.
某化学兴趣小组对铜与硝酸的反应进行下列探究.I.验证铜与稀硝酸反应生成的气体为NO如图1.
(1)仪器M的名称为干燥管
(2)完成下列表格.
| 操作步骤 | 实验现象 | 解释 |
| 打开弹簧夹K,拉注射器推筒,使稀硝酸吸到干燥管中并充满干燥管在关闭弹簧夹K | 仪器M中有无色气体 | 反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O |
| 打开弹簧夹K,使干燥管中无色气体进入注射器中 | 注射器中有红棕色气体 | 反应的化学方程式为2NO+O2=NO2 |
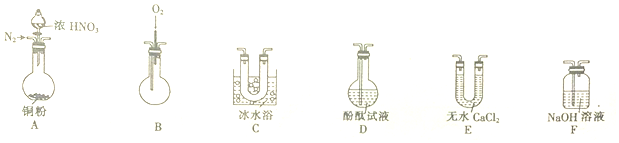
已知:
①NO+NO2+2OH-═2NO2-+H2O
②NO2、NO气体液化的温度如表.
| 气体 | NO2 | NO |
| 液化温度 | 21℃ | -152℃ |
(4)检查装置气密性后,再加入试剂,在反应前应进行的操作是通入氮气使装置中的空气排出目的是防止NO与空气中的氧气反应生成二氧化氮.