题目内容
4.下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸.当X无论是强酸还是强碱时,都有如下转化关系:A$\stackrel{X}{→}$B$\stackrel{Y}{→}$C$\stackrel{Y}{→}$D$\stackrel{Z}{→}$E
当X是强酸时,A、B、C、D、E均含有同一种元素,当X是强碱时,A、B、C、D、E均含有另外同一种元素.请回答:
(1)A是(NH4)2S,Y是O2,Z是H2O.
(2)当X是强酸时,E是H2SO4,写出B生成C的化学方程式:2H2S+3O2=2SO2+2H2O.
(3)当X是强碱时,E是HNO3,写出B生成C的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
分析 D的相对分子质量比C的大16,可判断D比C多一个氧原子,符合这种转化关系的有:SO2→SO3,NO→NO2,Na2SO3→Na2SO4等.由此可出推断Y为O2,由于E为酸,则D应为能转化为酸的某物质,很可能为SO3、NO2等.若D为SO3,顺推E为H2SO4,Z为H2O,逆推B为H2S,A为硫化物,此时X为强酸;若D为NO2,顺推E为HNO3,Z为H2O,逆推B为NH3,A为铵盐.综合而得A应为(NH4)2S,以此解答该题.
解答 解:(1)由以上分析可知A为(NH4)2S,Y为O2,Z为H2O,故答案为:(NH4)2S;O2;H2O;
(2)当X是强酸时,E是H2SO4,B为H2S,B生成C的化学方程式为2H2S+3O2=2SO2+2H2O,
故答案为:H2SO4;2H2S+3O2=2SO2+2H2O;
(3)X是强碱时,E是HNO3,B为NH3,B生成C的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:HNO3;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
点评 本题考查考查S和N元素及其化合物转化的有关判断,是中等难度的试题,也是高考中的常见题型.试题注重基础和能力的双向考查,该题的突破点是有关的反应条件以及能和强碱反应生成气体.本题有利于培养学生的逻辑思维能力,提高学生分析问题、解决问题的能力.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
14.铅蓄电池有广泛的应用,由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如图1:

査阅资料:①PbCl2(s)+2Cl-(aq)?PbCl42-(aq)△H>0
②Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9、7.0
③不同温度和浓度的食盐溶液中PbCl2的溶解度(g•L-1):
(1)步骤I中FeCl3溶液与PbS反应生成PbCl2和S的化学方程式为PbS+2FeCl3=PbCl2+2FeCl2+S;
加入盐酸控制pH小于1.0的原因是抑制Fe3+的水解.
(2)步骤II中浸泡溶解时采用95℃和饱和食盐水的目的分别是加快浸泡速率、增大PbCl2在氯化钠溶液中的溶解度.
(3)步骤III中将滤液B蒸发浓缩后再用冰水浴的原因是冰水浴使反应PbCl2(s)+2Cl-(aq)?PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出(请用平衡移动原理解释).
(4)步骤IV需用溶质质量分数为20%、密度为1.22g•cm-3的硫酸溶液,现用溶质质量分数为98.3%、密度为1.84g•cm-3的浓硫酸配制,需用到的玻璃仪器有ABE(填相应的字母).
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒 F.胶头滴管
(5)用铅蓄电池为电源,采用电解法分开处理含有Cr2O72-及含有NO2-的酸性废水(最终Cr2O72-转化为Cr(OH)3,NO2-转化为无毒物质),其装置如图2所示.
①左池中Cr2O72-转化为Cr3+的离子方程式是6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
②当阴极区消耗2mol NO2-时,右池减少的H+的物质的量为2 mol.

査阅资料:①PbCl2(s)+2Cl-(aq)?PbCl42-(aq)△H>0
②Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9、7.0
③不同温度和浓度的食盐溶液中PbCl2的溶解度(g•L-1):
| NaCl浓度(g.L-1) 温度(℃) | 20 | 40 | 60 | 100 | 180 | 260 | 300 |
| 13 | 3 | 1 | 0 | 0 | 3 | 9 | 13 |
| 50 | 8 | 4 | 3 | 5 | 10 | 21 | 35 |
| 100 | 17 | 11 | 12 | 15 | 30 | 65 | 95 |
加入盐酸控制pH小于1.0的原因是抑制Fe3+的水解.
(2)步骤II中浸泡溶解时采用95℃和饱和食盐水的目的分别是加快浸泡速率、增大PbCl2在氯化钠溶液中的溶解度.
(3)步骤III中将滤液B蒸发浓缩后再用冰水浴的原因是冰水浴使反应PbCl2(s)+2Cl-(aq)?PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出(请用平衡移动原理解释).
(4)步骤IV需用溶质质量分数为20%、密度为1.22g•cm-3的硫酸溶液,现用溶质质量分数为98.3%、密度为1.84g•cm-3的浓硫酸配制,需用到的玻璃仪器有ABE(填相应的字母).
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒 F.胶头滴管
(5)用铅蓄电池为电源,采用电解法分开处理含有Cr2O72-及含有NO2-的酸性废水(最终Cr2O72-转化为Cr(OH)3,NO2-转化为无毒物质),其装置如图2所示.
①左池中Cr2O72-转化为Cr3+的离子方程式是6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
②当阴极区消耗2mol NO2-时,右池减少的H+的物质的量为2 mol.
15.化学与生产、生活、社会密切相关,下列有关说法不正确的是( )
| A. | “地沟油”可以制成肥皂,提高资源的利用率 | |
| B. | 为防止食品氧化变质,常在食品包装袋中放入生石灰 | |
| C. | 用加热灼烧的方法可以区分羊毛毛线和腈纶毛线 | |
| D. | 加快开发髙效洁净能源转换技术,缓解能源危机 |
9.化学工作者一直关注食品安全,发现有人将工业染料“苏丹红1号”非法用作食用色素.苏丹红是一系列人工合成染料,其中“苏丹红4号”的结构式如图: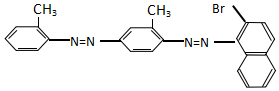
下列关于“苏丹红4号”说法正确的是( )

下列关于“苏丹红4号”说法正确的是( )
| A. | 不能发生加成反应 | B. | 属于甲苯同系物 | ||
| C. | 属于芳香烃 | D. | 能发生水解反应 |
16.氧杂环丙烷的结构如图所示.下列说法正确的是( )
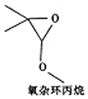

| A. | 该有机物的分子式为C5H9O2 | |
| B. | 该有机物能与金属钠反应 | |
| C. | 该有机物的同分异构体(不考虑立休异构)中,能水解生成羧酸与醇的物质共有9种 | |
| D. | 该有机物的同分异构体(不考虑立体异构)中,属于羧酸的物质共有5种 |
17. 汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.
汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.
(1)已知:
①CH4(g)+4NO2(g)$\stackrel{催化剂}{?}$ 4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)$\stackrel{催化剂}{?}$ 2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
③CH4(g)+2NO2(g) $\stackrel{催化剂}{?}$N2(g)+CO2(g)+2H2O(g)
△H3=-867kJ•mol-1.
(2)反应③在热力学上趋势很大,其原因是此反应放出的热量十分大.在固定容器中按一定比例混合CH4与NO2后,提高NO2转化率的反应条件是低温、低压
(3)在130℃和180℃时,分别将0.50mol CH4和a mol NO2充入1L的密闭容器中发生反应③,测得有关数据如表:
①开展实验1和实验2的目的是研究温度对该化学平衡的影响.
②130℃时,反应到20分钟时,NO2的反应速率是0.0125mol/(L•min).
③180℃时达到平衡状态时,CH4的平衡转化率为70%.
④已知130℃时该反应的化学平衡常数为6.4,试计算a=1.2.
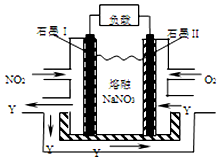
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图.该电池在使用过程中石墨I电极上生成氧化物Y,该电极反应为NO2+NO3--e-=N2O5.
 汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.
汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.(1)已知:
①CH4(g)+4NO2(g)$\stackrel{催化剂}{?}$ 4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)$\stackrel{催化剂}{?}$ 2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
③CH4(g)+2NO2(g) $\stackrel{催化剂}{?}$N2(g)+CO2(g)+2H2O(g)
△H3=-867kJ•mol-1.
(2)反应③在热力学上趋势很大,其原因是此反应放出的热量十分大.在固定容器中按一定比例混合CH4与NO2后,提高NO2转化率的反应条件是低温、低压
(3)在130℃和180℃时,分别将0.50mol CH4和a mol NO2充入1L的密闭容器中发生反应③,测得有关数据如表:
| 实验编号 | 温度 | 0分钟 | 10分钟 | 20分钟 | 40分钟 | 50分钟 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
②130℃时,反应到20分钟时,NO2的反应速率是0.0125mol/(L•min).
③180℃时达到平衡状态时,CH4的平衡转化率为70%.
④已知130℃时该反应的化学平衡常数为6.4,试计算a=1.2.
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图.该电池在使用过程中石墨I电极上生成氧化物Y,该电极反应为NO2+NO3--e-=N2O5.
18.我国首艘001A型国产航母在大连造船厂建造.下列有关说法正确的是( )
| A. | 升降机的Al-Mg合金焊接过程中,可采用N2作保护气 | |
| B. | 为降低舰体钢材料中硅含量,冶炼过程中需使用O2和CaCO3 | |
| C. | 为测定螺旋浆Cu-Al合金中铜元素含量,只需使用氨水 | |
| D. | 为防止舰体在海水中发生电化学腐蚀,可镶嵌铜块 |

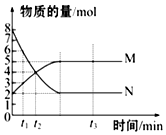 一定温度下,在容积为VL的密闭容器里进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为VL的密闭容器里进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示: