题目内容
12.检验SO42-离子,除了需要用到BaCl2,还要用到的试剂是( )| A. | HNO3 | B. | AgNO3 | C. | HCl | D. | H2SO4 |
分析 检验硫酸根离子时,选择盐酸排除碳酸根离子、银离子等干扰,再加氯化钡观察是否生成沉淀,以此来解答.
解答 解:A.硝酸可氧化亚硫酸根离子,干扰硫酸根离子检验,故A错误;
B.硫酸根离子、氯离子均与硝酸银反应生成沉淀,干扰硫酸根离子检验,故B错误;
C.HCl可排除碳酸根离子、银离子等干扰,再加氯化钡观察是否生成沉淀可检验SO42-,故C正确;
D.加H2SO4引入SO42-,干扰SO42-的检验,故D错误;
故选C.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象、结论为解答的关键,侧重分析与实验能力的考查,注意排除干扰离子的影响,题目难度不大.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
18.草酸二酯是荧光棒产生荧光现象的主要物质,其结构简式如图所示.下列有关说法正确的是( ) 

| A. | 草酸二酯的分子中所有碳原子一定共平面 | |
| B. | 草酸二酯水解后生成醇的分子式为C5H12O | |
| C. | 草酸二酯中苯环上氢原子被一个溴原子取代的有机产物有两种 | |
| D. | 1 mol草酸二酯与足量NaOH溶液反应最多消耗4 mol NaOH |
16.氧杂环丙烷的结构如图所示.下列说法正确的是( )
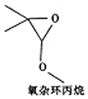

| A. | 该有机物的分子式为C5H9O2 | |
| B. | 该有机物能与金属钠反应 | |
| C. | 该有机物的同分异构体(不考虑立休异构)中,能水解生成羧酸与醇的物质共有9种 | |
| D. | 该有机物的同分异构体(不考虑立体异构)中,属于羧酸的物质共有5种 |
7.已知:①C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol
④C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
下列说法正确的是( )
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol
④C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
下列说法正确的是( )
| A. | 将2.4g炭完全转化为水煤气,然后再充分燃烧,整个过程放出热量39.35kJ | |
| B. | C的燃烧热为-110.5kJ/mol | |
| C. | H2的燃烧热为-241.8kJ/mol | |
| D. | 由反应③可知,反应过程中转移5mol电子且生成液态水时放出的热量大于604.5kJ |
17.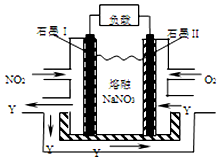 汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.
汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.
(1)已知:
①CH4(g)+4NO2(g)$\stackrel{催化剂}{?}$ 4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)$\stackrel{催化剂}{?}$ 2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
③CH4(g)+2NO2(g) $\stackrel{催化剂}{?}$N2(g)+CO2(g)+2H2O(g)
△H3=-867kJ•mol-1.
(2)反应③在热力学上趋势很大,其原因是此反应放出的热量十分大.在固定容器中按一定比例混合CH4与NO2后,提高NO2转化率的反应条件是低温、低压
(3)在130℃和180℃时,分别将0.50mol CH4和a mol NO2充入1L的密闭容器中发生反应③,测得有关数据如表:
①开展实验1和实验2的目的是研究温度对该化学平衡的影响.
②130℃时,反应到20分钟时,NO2的反应速率是0.0125mol/(L•min).
③180℃时达到平衡状态时,CH4的平衡转化率为70%.
④已知130℃时该反应的化学平衡常数为6.4,试计算a=1.2.
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图.该电池在使用过程中石墨I电极上生成氧化物Y,该电极反应为NO2+NO3--e-=N2O5.
 汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.
汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.(1)已知:
①CH4(g)+4NO2(g)$\stackrel{催化剂}{?}$ 4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)$\stackrel{催化剂}{?}$ 2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
③CH4(g)+2NO2(g) $\stackrel{催化剂}{?}$N2(g)+CO2(g)+2H2O(g)
△H3=-867kJ•mol-1.
(2)反应③在热力学上趋势很大,其原因是此反应放出的热量十分大.在固定容器中按一定比例混合CH4与NO2后,提高NO2转化率的反应条件是低温、低压
(3)在130℃和180℃时,分别将0.50mol CH4和a mol NO2充入1L的密闭容器中发生反应③,测得有关数据如表:
| 实验编号 | 温度 | 0分钟 | 10分钟 | 20分钟 | 40分钟 | 50分钟 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
②130℃时,反应到20分钟时,NO2的反应速率是0.0125mol/(L•min).
③180℃时达到平衡状态时,CH4的平衡转化率为70%.
④已知130℃时该反应的化学平衡常数为6.4,试计算a=1.2.
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图.该电池在使用过程中石墨I电极上生成氧化物Y,该电极反应为NO2+NO3--e-=N2O5.
4. 运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:
运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:
(1)用CO可以合成甲醇.已知:
CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H1kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3kJ•mol-1
则CO(g)+2H2(g)?CH3OH(g)△H=2△H3+△H2-△H1kJ•mol-1.
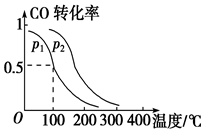
(2)一定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2,在催化剂作用下发生反应:CO(g)+2H2(g)?CH3OH(g)△H,平衡转化率与温度、压强的关系如图所示.
p2大于p1 (填“大于”、“小于”或“等于”);
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O.
(4)25℃,两种酸的电离平衡常数如表.
①HSO3-的电离平衡常数表达式K=$\frac{c(S{{O}_{3}}^{2-})c({H}^{+})}{c(HS{{O}_{3}}^{-})}$.
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
 运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:
运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:(1)用CO可以合成甲醇.已知:
CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H1kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3kJ•mol-1
则CO(g)+2H2(g)?CH3OH(g)△H=2△H3+△H2-△H1kJ•mol-1.
(2)一定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2,在催化剂作用下发生反应:CO(g)+2H2(g)?CH3OH(g)△H,平衡转化率与温度、压强的关系如图所示.
p2大于p1 (填“大于”、“小于”或“等于”);
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O.
(4)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
1.阿魏酸的结构简式为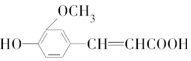 ,符合下列条件的阿魏酸的同分异构体的数目为
,符合下列条件的阿魏酸的同分异构体的数目为
①苯环上有两个取代基,且苯环上的一溴代物只有2种;
②能发生银镜反应;
③与碳酸氢钠溶液反应可生成使澄清石灰水变浑浊的气体;
④与FeCl3溶液发生显色反应.( )
 ,符合下列条件的阿魏酸的同分异构体的数目为
,符合下列条件的阿魏酸的同分异构体的数目为①苯环上有两个取代基,且苯环上的一溴代物只有2种;
②能发生银镜反应;
③与碳酸氢钠溶液反应可生成使澄清石灰水变浑浊的气体;
④与FeCl3溶液发生显色反应.( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
2.曙红可用作指示剂及染料,其结构简式如图所示.下列有关曙红的说法正确的是( ) 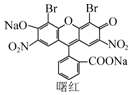

| A. | 不能与盐酸发生反应 | |
| B. | 分子中含1个手性碳原子 | |
| C. | 能发生取代、加成、消去反应 | |
| D. | 1 mol曙红最多能与4 mol NaOH反应 |
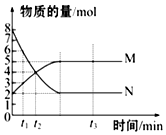 一定温度下,在容积为VL的密闭容器里进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为VL的密闭容器里进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示: