题目内容
18.苯甲醛(C6H5-CHO)在浓NaOH溶液中发生分子间的氧化还原反应,结果一半苯甲醛被氧化,一半苯甲醛被还原.由此判断,最终的反应产物是( )| A. | 苯甲醇 | B. | 苯甲酸钠 | ||
| C. | 苯甲醇和苯甲酸苯甲酯 | D. | 苯甲醇和苯甲酸钠 |
分析 一半苯甲醛被氧化,一半苯甲醛被还原,则-CHO分别转化为-OH、-COOH,以此来解答.
解答 解:一半苯甲醛被氧化,一半苯甲醛被还原,则-CHO分别转化为-OH、-COOH,可知生成苯甲醇、苯甲酸,苯甲酸与NaOH反应生成苯甲酸钠,
故选D.
点评 本题考查氧化还原反应,为高频考点,把握-CHO的性质为解答的关键,侧重分析与应用能力的考查,注意有机物的氧化还原反应的认识,题目难度不大.

练习册系列答案
相关题目
20.化学与生产、生活、社会密切相关,下列有关说法中正确的是( )
| A. | 海水中含有丰富的碘元素,因此碘被称为“海洋元素” | |
| B. | 地沟油经过加工处理后可用来制生物柴油和肥皂 | |
| C. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 | |
| D. | 大量使用薪柴为燃料,践行低碳生活 |
9.下列表示物质结构的化学用语或模型正确的是( )
| A. | 氟化氢的电子式: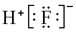 | B. | 白磷分子的球棍模型: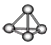 | ||
| C. | CO2分子的球棍模型: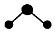 | D. | K+离子的结构示意图: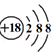 |
6.铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是( )
| A. | 电池的电解液为碱性溶液 | |
| B. | 电池放电时,负极反应为Fe+2OH--2e-═Fe(OH)2 | |
| C. | 放电时Ni2O3在正极被氧化 | |
| D. | 电池放电时,OH-往负极移动 |
3.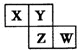 X、Y、Z、W均为短周期元素:在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )
X、Y、Z、W均为短周期元素:在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )
 X、Y、Z、W均为短周期元素:在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )
X、Y、Z、W均为短周期元素:在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )| A. | X、Y、Z的原子半径大小:X>Y>Z | |
| B. | Y、Z的气态氢化物的热稳定性:Y<Z | |
| C. | Z、W的最高价氧化物对应水化物的酸性:Z<W | |
| D. | X、W的气态氢化物相互反应,生成物中既含离子键又含极性键和非极性键 |
10.下列哪一种微粒的中心原子属于sp3杂化( )
| A. | BCl3 | B. | CO2 | C. | PCl3 | D. | HCHO |
1.下列关于烷烃的叙述中不正确的是( )
| A. | 在烷烃分子中,所有的化学键都为单键 | |
| B. | 所有的烷烃在一定条件下都能与Cl2发生取代反应 | |
| C. | 随着碳原子数的增加,烷烃的熔、沸点逐渐升高 | |
| D. | 任何烷烃分子中碳氢原子个数之比都是相同的 |