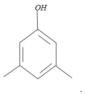
题目内容
6.铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是( )| A. | 电池的电解液为碱性溶液 | |
| B. | 电池放电时,负极反应为Fe+2OH--2e-═Fe(OH)2 | |
| C. | 放电时Ni2O3在正极被氧化 | |
| D. | 电池放电时,OH-往负极移动 |
分析 铁镍蓄电池放电时Fe作负极,发生氧化反应,失电子生成Fe2+,最终生成Fe(OH)2,负极电极反应为Fe+2OH--2e-═Fe(OH)2,Ni2O3作正极,发生还原反应,最终生成Ni(OH)2,所以正极反应为Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-,以此解答该题.
解答 解:A.由总方程式可知生成物均为氢氧化物,所以电池的电解液应该为碱性溶液,故A正确;
B.放电时Fe作负极,发生氧化反应,失电子生成Fe2+,最终生成Fe(OH)2,负极电极反应为Fe+20H-一2e-═Fe(OH)2,故B正确;
C.原电池工作时正极发生还原反应,故C错误;
D.原电池工作时,阳离子向正极移动,阴离子向负极移动,故D正确.
故选C.
点评 本题考查电池的工作原理,涉及到原电池的有关知识,为高频考点,侧重考查学生的分析能力,做题时注意根据总反应从氧化还原的角度判断化合价的变化,以得出电池的正负极以及所发生的反应,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.有关石油和石油炼制的下列说法中错误的是( )
| A. | 石油主要是由气态烃、液态烃和固态烃组成的混合物 | |
| B. | 减压蒸馏的主要产品为汽油、煤油和柴油 | |
| C. | 催化裂化的目的是提高汽油、煤油和柴油等轻质油的产量 | |
| D. | 催化重整使链状烃转化为环状烃,目的是提高汽油等轻质油的品质 |
14.有关化学用语正确的是( )
| A. | 乙烯的结构简式C2H4 | B. | 乙烷的结构式CH3CH3 | ||
| C. | 四氯化碳的电子式 | D. | 乙酸的分子式C2H4O2 |
18.苯甲醛(C6H5-CHO)在浓NaOH溶液中发生分子间的氧化还原反应,结果一半苯甲醛被氧化,一半苯甲醛被还原.由此判断,最终的反应产物是( )
| A. | 苯甲醇 | B. | 苯甲酸钠 | ||
| C. | 苯甲醇和苯甲酸苯甲酯 | D. | 苯甲醇和苯甲酸钠 |
15.某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
下列回答错误的是( )
| 编号 | 电极材料. | 电解质溶液 | 电流计指针 |
| 1 | Mg、Al | 稀盐酸 | 偏转 |
| 2 | Al、Cu | 稀盐酸 | 偏转 |
| 3 | A1、C(石墨) | 稀盐酸 | 偏转 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏转 |
| 5 | Al、Zn | 浓硝酸 | 偏转 |
| A. | 实验1、2中铝所作的电极(正极或负极)不相同 | |
| B. | 实验2、3中,铝电极的电极反应式均为Al-3e-═Al3+ | |
| C. | 实验4中铝电极的电极反应式为:Al-3e-+40H-═A102-+2H2O | |
| D. | 实验5中铝作原电池的负极 |
16.在元素周期表中金属与非金属的分界处,可以找到( )
| A. | 合金 | B. | 农药 | C. | 催化剂 | D. | 半导体材料 |

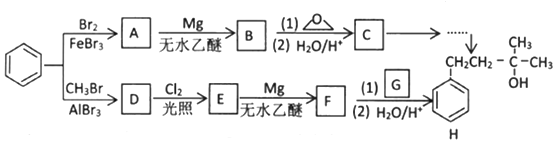
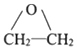 →R-CH2CH2OMgX<“m“:math dsi:zoomscale=150 dsi:_mathzoomed=1>→H2O/H+$\stackrel{H_{2}O/H+}{→}$R-CH2CH2OH
→R-CH2CH2OMgX<“m“:math dsi:zoomscale=150 dsi:_mathzoomed=1>→H2O/H+$\stackrel{H_{2}O/H+}{→}$R-CH2CH2OH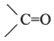 →
→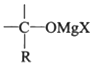 $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$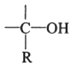
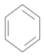 +CH3Br$→_{.}^{AlBr_{3}}$
+CH3Br$→_{.}^{AlBr_{3}}$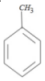 +HBr
+HBr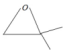
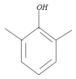 ,
,