题目内容
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示 ,K值大小与温度的关系是:温度升高,K值 (填“一定增大”、“一定减小”或“可能增大也可能减小”).
(2)反应Fe2O3(s)+3CO(g)
2Fe(s)+3CO2(g)在一容积可变的密闭容器中进行,试回答:
(a)增加Fe的量,其反应速率 (填“加快”、“不变”或“减慢”,下同).
(b)将容器的体积缩小一半,其反应速率 .
(c)保持体积不变,充入Ne使体系压强增大,其正反应速率 .
(d)保持压强不变,充入Ne使容器的体积增大,其正反应速率 .
(3)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2气体和液态水时放出22.68kJ的热量,则该反应的热化学方程式为 .
(4)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol ③
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式: .
(2)反应Fe2O3(s)+3CO(g)
| ||
(a)增加Fe的量,其反应速率
(b)将容器的体积缩小一半,其反应速率
(c)保持体积不变,充入Ne使体系压强增大,其正反应速率
(d)保持压强不变,充入Ne使容器的体积增大,其正反应速率
(3)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2气体和液态水时放出22.68kJ的热量,则该反应的热化学方程式为
(4)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol ③
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
考点:化学平衡的影响因素,热化学方程式,化学反应速率的影响因素
专题:基本概念与基本理论
分析:(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大,化学平衡常数只受温度影响,根据升高温度导致平衡的移动方向分析判断;
(2)(a)改变纯固体的量,对反应速率无影响;
(b)将容器的体积缩小一半,气体的浓度变大,反应速率加快;
(c)保持体积不变,充入N2使体系压强增大,反应体系中各物质的浓度不变;
(d)保持压强不变,充入N2使容器的体积增大,反应体系中气体的浓度减小;
(3)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,题干所给量计算32g甲醇燃烧生成二氧化碳和液态水放热,结合热化学方程式书写方法,标注物质聚集状态和对应焓变;
(4)根据盖斯定律将三个化学方程式进行处理,得到所需热化学方程式;
(2)(a)改变纯固体的量,对反应速率无影响;
(b)将容器的体积缩小一半,气体的浓度变大,反应速率加快;
(c)保持体积不变,充入N2使体系压强增大,反应体系中各物质的浓度不变;
(d)保持压强不变,充入N2使容器的体积增大,反应体系中气体的浓度减小;
(3)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,题干所给量计算32g甲醇燃烧生成二氧化碳和液态水放热,结合热化学方程式书写方法,标注物质聚集状态和对应焓变;
(4)根据盖斯定律将三个化学方程式进行处理,得到所需热化学方程式;
解答:
解:(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大;
化学平衡常数只受温度影响,若正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,若正反应为吸热反应,升高温度平衡向正反应方向移动,平衡常数增大,故升高温度,平衡常数可能增大也可能减小,
故答案为:可逆反应进行的程度越大;可能增大也可能减小;
(2)(a)改变纯固体的量,对反应速率无影响,则增加Fe的量,其正反应速率不变,故答案为:不变;
(b)将容器的体积缩小一半,气体的浓度变大,反应速率加快,则正逆反应速率均加快,故答案为:加快;
(c)保持体积不变,充入Ne使体系压强增大,反应体系中各物质的浓度不变,则正逆反应速率不变,故答案为:不变;
(d)保持压强不变,充入Ne使容器的体积增大,反应体系中气体的浓度减小,则正反应速率减慢,故答案为:减慢;
(3)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为725.76KJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ?mol-1,
故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ?mol-1;
(4)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol ③
①×3-②-③×2得
6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+640.5kJ/mol)×2=-1308.0kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol.
化学平衡常数只受温度影响,若正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,若正反应为吸热反应,升高温度平衡向正反应方向移动,平衡常数增大,故升高温度,平衡常数可能增大也可能减小,
故答案为:可逆反应进行的程度越大;可能增大也可能减小;
(2)(a)改变纯固体的量,对反应速率无影响,则增加Fe的量,其正反应速率不变,故答案为:不变;
(b)将容器的体积缩小一半,气体的浓度变大,反应速率加快,则正逆反应速率均加快,故答案为:加快;
(c)保持体积不变,充入Ne使体系压强增大,反应体系中各物质的浓度不变,则正逆反应速率不变,故答案为:不变;
(d)保持压强不变,充入Ne使容器的体积增大,反应体系中气体的浓度减小,则正反应速率减慢,故答案为:减慢;
(3)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为725.76KJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
(4)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol ③
①×3-②-③×2得
6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+640.5kJ/mol)×2=-1308.0kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol.
点评:本题考查化学反应速率的影响因素的分析判断,然后洗发水和盖斯定律计算应用,综合性较强,注重对常考查点的考查,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
设NA为阿佛加德罗常数,下列叙述中正确的是( )
| A、100mL 3mol/L盐酸与5.6g Fe充分反应转移0.3NA个电子 |
| B、标准状况下,22.4L乙醇中含有的碳原子数目为2NA个 |
| C、16g O2和O3的混合物中含有的氧原子数目为NA个 |
| D、0.05mol熔融的CaCl2中含有0.1NA个阳离子 |
 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 化工工业中常用乙苯脱氢的方法制备苯乙烯.已知某温度下:
化工工业中常用乙苯脱氢的方法制备苯乙烯.已知某温度下: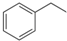 (g)?
(g)?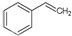 (g)+H2(g),△H=+117.6kJ/mol.
(g)+H2(g),△H=+117.6kJ/mol.