题目内容
13.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 3.0g甲醛和甲酸甲酯的混合物中含有的原子数为0.4NA | |
| B. | 常温下,1L0.1mol•L-1CuSO4溶液中粒子总数小于0.2NA | |
| C. | 1 mol冰醋酸和1 mol乙醇在浓硫酸加热下充分反应生成H2O个数为NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3NA |
分析 A.甲醛和甲酸甲酯的最简式均为CH2O;
B.粒子指代不明;
C.酯化反应为可逆反应,不能进行到底;
D.5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,转移15mol电子时生成4mol氮气.
解答 解:A.甲醛和甲酸甲酯的最简式均为CH2O,故3.0g混合物中含有的CH2O的物质的量为n=$\frac{3.0g}{30g/mol}$=0.1mol,故含0.4mol原子即0.4NA个,故A正确;
B.1L0.1mol•L-1CuSO4溶液中,含有铜离子、硫酸根离子,水分子,题干未指明微粒种类,无法判断,故B错误;
C.1 mol冰醋酸和1 mol乙醇在浓硫酸加热下充分反应生成H2O个数少于NA,故C错误;
D.5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,转移15mol电子时生成4mol氮气,则生成28g N2时,转移的电子数目为3.75NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,注意有机物结构特点、可逆反应不能进行到底的特点,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.根据下列实验设计及有关现象,所得结论正确的是( )
| 实验 | 实验现象 | 结 论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Cu>Fe |
B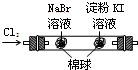 | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 白色固体先变为淡黄色,后变为黑色(Ag2S) | 溶解性:AgCl>AgBr>Ag2S |
D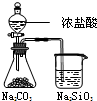 | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 酸性:HCl>H2CO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
18.下列物质性质和应用的对应关系正确的是( )
| A. | 84消毒液具有碱性,可用作消毒剂和漂白剂 | |
| B. | 氢氟酸具有酸性,可用于玻璃的腐蚀剂 | |
| C. | 过氧化钠具有漂白性,可作航空和潜水的供氧剂 | |
| D. | 活性铁粉具有还原性,在食品袋中可用作除氧剂 |
2.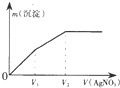 往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )
往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )
 往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )
往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )| A. | $\frac{{V}_{2}-{V}_{1}}{{V}_{1}}$ | B. | $\frac{{V}_{1}}{{V}_{2}}$ | C. | $\frac{{V}_{1}}{{V}_{2}-{V}_{1}}$ | D. | $\frac{{V}_{2}}{{V}_{1}}$ |
19.t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
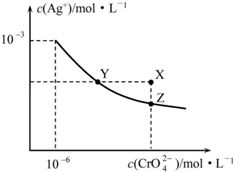

| A. | 在t℃时,Ag2CrO4的Ksp=1×10-9 | |
| B. | X点有Ag2CrO4沉淀生成 | |
| C. | 通过加热蒸发可以使溶液由Y点变到Z点 | |
| D. | 在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点变到X点最终变到Z点 |

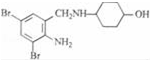 ,不考虑立体异构)是临床上使用广泛的药物.如图所示的为其多条合成路线中的一条(反应试剂和反应条件均未标出)
,不考虑立体异构)是临床上使用广泛的药物.如图所示的为其多条合成路线中的一条(反应试剂和反应条件均未标出)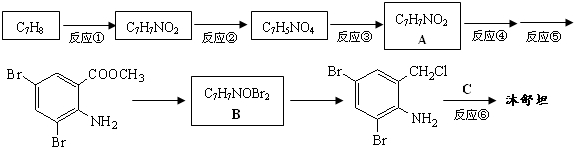
 ,完成下列填空:
,完成下列填空: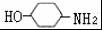 +2
+2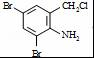 +K2CO3→2
+K2CO3→2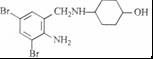 +2KCl+CO2↑+H2O.
+2KCl+CO2↑+H2O.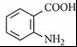 B
B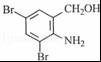 .
.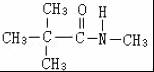 、
、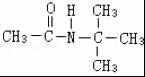 .
.