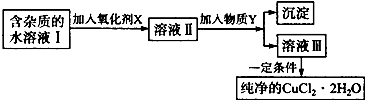
题目内容
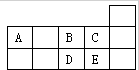 如表为元素周期表短周期的一部分.下列有关A、B、C、D、E五种元素的叙述中,不正确的是( )
如表为元素周期表短周期的一部分.下列有关A、B、C、D、E五种元素的叙述中,不正确的是( )| A、A与B形成的阴离子可能有:AB32-、A2B42- |
| B、E的氢化物的沸点比C的氢化物的沸点低 |
| C、D在过量的B中燃烧的主要产物为DB3 |
| D、这5种元素形成只含极性键的非极性分子多于4种 |
考点:原子结构与元素的性质
专题:
分析:由A、B、C、D、E五种元素在短周期中的相对位置可知,A为碳元素,B为氧元素,C为氟元素,D为硫元素,E为氯元素.
A.碳元素与氧元素可以形成碳酸根与草酸根离子;
B.氟化氢分子中存在氢键,沸点相对较高;
C.硫在氧气中燃烧生成二氧化硫;
D.由这5种元素中的几种形成只含极性键的非极性分子有二氧化碳、二硫化碳、三氧化硫、四氟化碳、四氯化碳.
A.碳元素与氧元素可以形成碳酸根与草酸根离子;
B.氟化氢分子中存在氢键,沸点相对较高;
C.硫在氧气中燃烧生成二氧化硫;
D.由这5种元素中的几种形成只含极性键的非极性分子有二氧化碳、二硫化碳、三氧化硫、四氟化碳、四氯化碳.
解答:
解:由A、B、C、D、E五种元素在短周期中的相对位置可知,A为碳元素,B为氧元素,C为氟元素,D为硫元素,E为氯元素.
A.A为碳元素,B为氧元素,碳元素与氧元素可以形成碳酸根离子(CO32-)、草酸根离子C2O42-,故A正确;
B.氟化氢分子中存在氢键,氢键比分子间作用力强,氟化氢的沸点高于氯化氢,故B正确;
C.硫在氧气中燃烧生成二氧化硫,不能生成三氧化硫,二氧化硫在催化剂、加热条件下生成三氧化硫,故C错误;
D.由这5种元素中的几种形成只含极性键的非极性分子有二氧化碳、二硫化碳、三氧化硫、四氟化碳、四氯化碳等,故D正确.
故选:C.
A.A为碳元素,B为氧元素,碳元素与氧元素可以形成碳酸根离子(CO32-)、草酸根离子C2O42-,故A正确;
B.氟化氢分子中存在氢键,氢键比分子间作用力强,氟化氢的沸点高于氯化氢,故B正确;
C.硫在氧气中燃烧生成二氧化硫,不能生成三氧化硫,二氧化硫在催化剂、加热条件下生成三氧化硫,故C错误;
D.由这5种元素中的几种形成只含极性键的非极性分子有二氧化碳、二硫化碳、三氧化硫、四氟化碳、四氯化碳等,故D正确.
故选:C.
点评:本题考查元素周期表、物质性质与分子极性等,难度中等,注意基础知识与元素周期表的掌握.

练习册系列答案
相关题目
下列反应处于平衡状态,2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1,欲提高平衡常数K的值,应采取的措施是( )
| A、降低温度 | B、增大压力 |
| C、加入氧气 | D、去掉三氧化硫 |
在常温下,某溶液中由水电离出的 c(H+)=1×10-11mol?L-1,下列说法正确的是( )
| A、该溶液肯定显碱性 |
| B、该溶液肯定显酸性 |
| C、该溶液的pH可能是11,也可能是3 |
| D、该溶液的pH肯定不是11 |
下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快的是( )
| A、V(H2)=0.1 mol?Lˉ1?minˉ1 |
| B、V(N2)=0.1 mol?Lˉ1?minˉ1 |
| C、V(NH3)=0.15 mol?Lˉ1?minˉ1 |
| D、V(N2)=0.002 mol?Lˉ1?sˉ1 |
我国著名化学家徐光宪因在稀土元素研究领域作出突出贡献荣获2008 年“国家最高科学技术奖”.稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应.已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+.下列说法正确的是( )
| A、电解熔融CeO2制Ce,铈在阳极获得 | ||||||||
| B、铈溶于氢碘酸的化学方程式可表示为:Ce+4HI═CeI4+2H2↑ | ||||||||
| C、用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ | ||||||||
D、四种稳定的核素
|
 2008年北京奥运会主体育场的外形好似“鸟巢”(The Bird Nest).有一类硼烷也好似鸟巢,故称为巢式硼烷.巢式硼烷除B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化.如图是三种巢式硼烷,有关说法正确的是( )
2008年北京奥运会主体育场的外形好似“鸟巢”(The Bird Nest).有一类硼烷也好似鸟巢,故称为巢式硼烷.巢式硼烷除B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化.如图是三种巢式硼烷,有关说法正确的是( )| A、这类巢式硼烷的通式是BnHn+4 | ||||
B、2B5H9+12O2
| ||||
| C、8个硼原子的巢式硼烷化学式应为B8H10 | ||||
| D、硼烷与水反应是非氧化还原反应 |