题目内容
2.可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),该可逆反应投入等物质的量NH3和O2在10L的密闭容器中进行,30秒后,水蒸气的物质的量增加了4.2mol,此时NH3和O2的浓度之比为2:1.求:(1)反应前NH3的浓度;
(2)以NO表示该反应的反应速率.
分析 投入等物质的量NH3和O2在10L的密闭容器中进行,设反应前NH3的物质的量为x,30秒后,水蒸气的物质的量增加了4.2mol,则
4NH3(g)+5O2(g)?4NO(g)+6H2O(g),
起始(mol) x x 0 0
转化(m)l) 2.8 3.5 2.8 4.2
30秒后(mol) x-2.8 x-3.5 2.8 4.2
30秒后,NH3和O2的浓度之比为2:1,
则(x-2.8):(x-3.5)=2:1,以此解答该题.
解答 解:投入等物质的量NH3和O2在10L的密闭容器中进行,设反应前NH3的物质的量为x,30秒后,水蒸气的物质的量增加了4.2mol,则
4NH3(g)+5O2(g)?4NO(g)+6H2O(g),
起始(mol) x x 0 0
转化(m)l) 2.8 3.5 2.8 4.2
30秒后(mol) x-2.8 x-3.5 2.8 4.2
30秒后,NH3和O2的浓度之比为2:1,则物质的量之比也为2:1,
则(x-2.8):(x-3.5)=2:1,
x=4.2mol,
(1)反应前NH3的浓度为$\frac{4.2mol}{10L}$=0.42mol/L,
答:反应前NH3的浓度为0.42mol/L;
(2)以NO表示该反应的反应速率为$\frac{\frac{2.8mol}{10L}}{30s}$=0.0093mol/(L•s),
答:以NO表示该反应的反应速率为0.0093mol/(L•s).
点评 本题考查化学平衡的计算,为高考常见题型和高频考点,侧重考查学生的分析、计算能力,注意把握数据的处理,掌握好三段式的计算方法,难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 1 mol D2O分子所含的中子数为8NA | |
| B. | 48 g氧气和臭氧的混合气体中的氧原子数为3NA | |
| C. | 11.2 L 甲烷(CH4)中的共价键数为2NA | |
| D. | 1 mol N2与3 mol H2反应生成的NH3分子数为2NA |
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SiF4和SO32-的中心原子均为sp2杂化 | |
| D. | SF6中有6对相同的成键电子对 |
| A. | 硅酸:粘合剂、耐火材料 | B. | 硅胶:干燥剂、吸附剂、催化剂载体 | ||
| C. | 碳化硅:砂纸、砂轮 | D. | 分子筛:吸附剂、催化剂 |
| 时间(min) | 0 | t1 | t2 | t3 |
| NH3的物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
| A. | 0~t1min内,v(NH3)=$\frac{0.2}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移 | |
| C. | N2(g)+3H2(g)?2NH3(g)的活化能小于2NH3(g)?N2(g)+3H2(g)的活化能 | |
| D. | t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol•L-1 |
| A. | 甲为铁锈 | B. | 乙为FeO | C. | 丙为NO2 | D. | 丁为CuCl2 |
①在元素周期表中,Z与Y、W均相邻;
②X、Y、W分别位于不同周期;
③Y、Z、W三种元素的原子最外层电子数之和为17.
下列说法错误的是( )
| A. | X、Y、Z既能形成离子化合物.又能形成共价化合物 | |
| B. | Y和Z元素的原子半径大小顺序为Y>Z | |
| C. | X与Y、Z之问形成的核外电子总数为10的微粒只有YX3和X2Z | |
| D. | Z、W元索的最简单氢化物的沸点和稳定性均为H2Z>H2W |
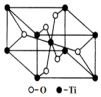 钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4: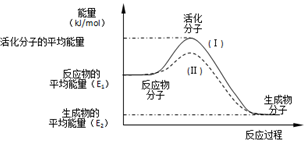 在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.
在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.