题目内容
14.一定温度下,在1L恒容密闭容器中加入1mol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g)?2NH3(g);△H<0,NH3的物质的量与时间的关系如表所示,下列说法错误的是( )| 时间(min) | 0 | t1 | t2 | t3 |
| NH3的物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
| A. | 0~t1min内,v(NH3)=$\frac{0.2}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移 | |
| C. | N2(g)+3H2(g)?2NH3(g)的活化能小于2NH3(g)?N2(g)+3H2(g)的活化能 | |
| D. | t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol•L-1 |
分析 A.根据v=$\frac{△c(N{H}_{3})}{t}$计算;
B.升高温度正逆反应速率均增大,化学平衡向吸热方向移动;
C.△H=正反应的活化能-逆反应的活化能;
D.原来平衡时,生成氨气为0.3mol,消耗氮气为0.15mol,则剩余的氮气为0.85mol,再加入1mol的N2(g),根据可逆反应的特点分析.
解答 解:A.0~t1min内,NH3的浓度增大0.2mol/L,则v(NH3)=$\frac{△c(N{H}_{3})}{t}$=$\frac{0.2}{{t}_{1}}$mol•L-1•min-1;故A正确;
B.升高温度正逆反应速率均增大,化学平衡向吸热方向移动,由于该反应正方向为放热反应,所以平衡逆移,故B错误;
C.△H=正反应的活化能-逆反应的活化能<0,所以正反应的活化能<逆反应的活化能,即N2(g)+3H2(g)?2NH3(g)的活化能小于2NH3(g)?N2(g)+3H2(g)的活化能,故C正确;
D.原来平衡时,生成氨气为0.3mol,消耗氮气为0.15mol,则剩余的氮气为0.85mol,再加入1mol的N2(g),平衡向正方向移动,由于可逆反应中反应物不能全部转化为生成物,所以加入的1mol的N2(g)不能全部反应,即后来平衡时氮气的物质的量大于0.85mol,则c(N2)>0.85mol•L-1,故D正确.
故选B.
点评 本题考查了化学平衡的有关计算、化学反应速率的影响、化学平衡移动,侧重于学生的分析能力和计算能力的考查,题目难度中等,答题时注意把握反应的特点以及平衡的影响因素.

练习册系列答案
相关题目
9.通常情况下,氣化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如图所示:
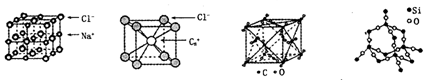
下列关于这些晶体结构和性质的叙述不正确的是( )

下列关于这些晶体结构和性质的叙述不正确的是( )
| A. | 同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同 的晶体结构 | |
| B. | 氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似物理 性质 | |
| C. | 二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键 | |
| D. | 二氧化硅晶体不是密堆积结构 |
9.已知:Ksp[Mg(OH)2]=1.8×10-11 Ksp[Zn(OH)2]=1.0×10-17
Ksp[Cr(OH)3]=7.0×10-31 Ksp[Fe(OH)3]=4.0×10-38
若将浓度均为0.01mol/L的Fe3+、Cr3+、Zn2+、Mg2+四种离子组成溶液的pH控制在9附近,溶液中四种离子的浓度由大到小排列顺序正确是( )
Ksp[Cr(OH)3]=7.0×10-31 Ksp[Fe(OH)3]=4.0×10-38
若将浓度均为0.01mol/L的Fe3+、Cr3+、Zn2+、Mg2+四种离子组成溶液的pH控制在9附近,溶液中四种离子的浓度由大到小排列顺序正确是( )
| A. | Mg2+、Zn2+、Cr3+、Fe3+ | B. | Cr3+、Fe3+、Zn2+、Mg2+ | ||
| C. | Fe3+、Cr3+、Zn2+、Mg2+ | D. | Zn2+、Mg2+、Cr3+、Fe3+ |
6.下列变化属于放热反应的是( )
①碳与二氧化碳化合 ②生石灰与水反应生成熟石灰 ③Zn与稀硫酸反应
④浓硫酸溶于水 ⑤Ba(OH)2•8H2O与NH4Cl反应 ⑥甲烷与氧气的燃烧.
①碳与二氧化碳化合 ②生石灰与水反应生成熟石灰 ③Zn与稀硫酸反应
④浓硫酸溶于水 ⑤Ba(OH)2•8H2O与NH4Cl反应 ⑥甲烷与氧气的燃烧.
| A. | ①②④⑥ | B. | ①④⑤ | C. | ②③⑥ | D. | ②④⑥ |
3.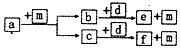 短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:W<X<Y<Z | |
| B. | 阴离子的还原性:Y>W | |
| C. | 图中物质的转化过程均为氧化还原反应 | |
| D. | a一定由W、X两种元素组成 |
4.NO因污染空气而“臭名昭著”,而奇妙的作用也使期成为“明星分子”.如可用于制HNO3.肥料.炸药.促进血管扩张.促进免疫功能.增强记忆等.下列各组物质中,不能生成NO的是( )
| A. | Cu+HNO3(稀) | B. | N2+O2 | C. | NH4Cl+O2 | D. | NO2+H2O |



