题目内容
15.下列描述中正确的是( )| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SiF4和SO32-的中心原子均为sp2杂化 | |
| D. | SF6中有6对相同的成键电子对 |
分析 A.CS2与CO2分子构型相同,根据二氧化碳的分子结构分析,结构对称,正负电荷的中心重合,则为非极性分子;结构不对称,正负电荷的中心不重合,为极性分子;
B.先求出中心原子的价层电子对数,再判断微粒构型;
C.先求出中心原子的价层电子对数,再判断杂化类型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数;
D.SF6中S-F含有一个成键电子对,硫原子最外层有6个电子,和氟原子之间有6对完全相同的成键电子对.
解答 解:A.CS2与CO2分子构型相同,二氧化碳的分子结构为O=C=O,则CS2的结构为S=C=S,CS2含有C=S极性键,分子为线型结构,结构对称,正负电荷的中心重合,为非极性分子,故A错误;
B.ClO3-中Cl的价层电子对数=3+$\frac{1}{2}$(7+1-2×3)=4,含有一个孤电子对,则离子的空间构型为三角锥形,故B错误;
C.SiF4中Si的价层电子对数=4+$\frac{1}{2}$(4-1×4)=4,SO32-中S的价层电子对数=3+$\frac{1}{2}$(6+2-2×3)=4,所以中心原子均为sp3杂化,故C错误;
D.SF6中S-F含有一个成键电子对,硫原子最外层有6个电子,和氟原子之间有6对完全相同的成键电子对,所以SF6中含有6个S-F键,则分子中有6对完全相同的成键电子对,故D正确;
故选D.
点评 本题考查分子的构型、原子杂化方式判断等知识点,侧重考查基本理论,难点是判断原子杂化方式,知道孤电子对个数的计算方法,为易错点,题目难度中等.

练习册系列答案
相关题目
5.下列各组物质含有的化学键类型完全相同的是( )
| A. | HBr、CO2、NH3 | B. | Na2O、Na2O2、Na2S | C. | NaCl、HCl、H2O | D. | NaOH、CaCl2 CaO |
3.元素X、Y可组成化学式为XY2的离子化合物,则X、Y的原子序数可能是( )
| A. | 11和16 | B. | 6和8 | C. | 12和17 | D. | 20和8 |
20.下列各项中表达正确的是( )
| A. | H、D、T表示同一种核素 | B. | F-离子结构示意图 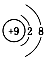 | ||
| C. | 次氯酸电子式  | D. | 用电子式表示HCl形成过程 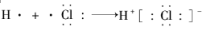 |
20.下列说法不正确的是( )
| A. | 干冰蒸发要吸收大量的热,这不是化学反应中的吸热现象 | |
| B. | 酒精常被用作酒精灯和内燃机中的燃料,说明酒精燃烧是放热反应 | |
| C. | 木炭常温下不燃烧,加热才能燃烧,说明木炭燃烧是吸热反应 | |
| D. | 人们用氢氧焰焊接金属,主要是利用了氢气和氧气化合时所放出的能量 |



