题目内容
下列依据热化学方程式得出的结论正确的是( )
| A、已知2H2(g)+O2(g)=2H2O(l)△H=-483.6 kJ?mol-1,则氢气的燃烧热为483.6 kJ?mol-1 |
| B、已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| C、已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2 则△H1>△H2 |
| D、已知Ni(CO)4(s)=Ni(s)+4CO(g)△H=Q kJ?mol-1,则Ni(s)+4CO(g)=Ni(CO)4(s)△H=-Q kJ?mol-1 |
考点:反应热和焓变,热化学方程式
专题:化学反应中的能量变化
分析:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B、依据能量越高越活泼分析判断;
C、一氧化碳燃烧生成二氧化碳过程是放出热量;
D、方程式反写时,反应热的符号相反.
B、依据能量越高越活泼分析判断;
C、一氧化碳燃烧生成二氧化碳过程是放出热量;
D、方程式反写时,反应热的符号相反.
解答:
解:A、选项中氢气的物质的量不是1mol,则反应热不是氢气的燃烧热,故A错误;
B、已知C(石墨,s)=C(金刚石,s);△H>0,反应是吸热反应,金刚石能量高于石墨,所以石墨比金刚石稳定,故B错误;
C、已知2C(s)+2O2(g)=2CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2,一氧化碳燃烧生成二氧化碳放热,焓变是负值,所以△H1<△H2,故C错误;
D、已知Ni(CO)4(s)=Ni(s)+4CO(g)△H=Q kJ?mol-1,方程式反写即为Ni(s)+4CO(g)=Ni(CO)4(s)△H=-Q kJ?mol-1,所以二者反应热大小相同,符号相反,故D正确;
故选D.
B、已知C(石墨,s)=C(金刚石,s);△H>0,反应是吸热反应,金刚石能量高于石墨,所以石墨比金刚石稳定,故B错误;
C、已知2C(s)+2O2(g)=2CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2,一氧化碳燃烧生成二氧化碳放热,焓变是负值,所以△H1<△H2,故C错误;
D、已知Ni(CO)4(s)=Ni(s)+4CO(g)△H=Q kJ?mol-1,方程式反写即为Ni(s)+4CO(g)=Ni(CO)4(s)△H=-Q kJ?mol-1,所以二者反应热大小相同,符号相反,故D正确;
故选D.
点评:本题考查了热化学方程式的书写方法,燃烧热,中和热概念分析应用,掌握概念实质是关键,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
下列化学用语表达正确的是( )
A、磷原子的原子结构示意: |
B、钠离子的电子式: |
C、甲烷的结构式: |
| D、质子数为8,中子数为10的核素:10O |
下列离子方程式书写正确的是( )
| A、过量氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-═6Cl-+2Fe3++2Br2 |
| B、过量二氧化碳通入偏铝酸钠溶液中:CO2+2H2O+AlO2-═Al(OH)3↓+CO32- |
| C、在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合:NH4++HSO3-+2OH-═SO32-+NH3↑+2H2O |
| D、碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ |
下列有关碱金属元素的性质判断正确的是( )
| A、K与水反应最剧烈 |
| B、Rb比Na活泼,故Rb可以从Na的盐溶液中置换出Na |
| C、碱金属的阳离子没有还原性,所以有强氧化性 |
| D、从Li到Cs都易失去最外层一个电子,且失电子能力逐渐增强 |
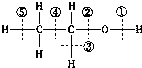 乙醇分子中各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )
乙醇分子中各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )| A、和金属钠反应时键①断裂 |
| B、和浓H2SO4共热到170℃时键②和⑤断裂 |
| C、和浓H2SO4共热到140℃时仅有键②断裂 |
| D、在Ag催化下与O2反应时键①和③断裂 |
 阿司匹林是常见的解热镇痛药,结构简式如图所示,有关阿司匹林的说法正确的是( )
阿司匹林是常见的解热镇痛药,结构简式如图所示,有关阿司匹林的说法正确的是( )| A、能发生取代、酯化反应,但不能发生氧化、还原反应 |
| B、阿司匹林分子中最多可以有13个原子在同一平面上 |
| C、1mol该物质完全氧化最多可消耗10mol氧气 |
| D、1mol该物质最多可与3mol NaOH发生反应 |
实验室欲配制一种仅含四种离子(不考虑来源于水电离的离子)的溶液,且溶液中四种离子的浓度均为1mol?L-1,能达到此目的是( )
| A、Al3+、K+、SO42-、NO3- |
| B、ClO-、I-、K+、H+ |
| C、Na+、Mg2+、SO42-、Cl- |
| D、Ba2+、OH-、CO32-、K+ |